
| A. | 要鉴别己烯中是否混有少量甲苯,应先加足量溴水,然后再加入酸性高锰酸钾溶液 | |
| B. | 配制浓硫酸和浓硝酸的混酸时,将浓硝酸沿壁缓缓倒入到浓硫酸中 | |
| C. | 制硝基苯时,将盛有混合液的试管直接在酒精灯火焰上加热 | |
| D. | 除去溴苯中少量的溴,可以加水后分液 |
分析 A.乙烯与溴水发生加成反应,甲苯可被酸性高锰酸钾氧化;
B.加入浓硫酸时,应防止酸液飞溅;
C.应水浴加热;
D.溴易溶于溴苯,应加氢氧化钠溶液.
解答 解:A.乙烯、甲苯都可被酸性高锰酸钾氧化,可先加溴水,乙烯与溴水发生加成反应,然后再用高锰酸钾检验是否含有甲苯,故A正确;
B.加入浓硫酸时,应将浓硫酸缓缓加入浓硝酸中,防止酸液飞溅,故B错误;
C.因苯、硝酸易挥发,制硝基苯,应水浴加热,故C错误;
D.溴易溶于溴苯,应加氢氧化钠溶液,故D错误.
故选A.
点评 本题考查较为综合,涉及物质的检验、鉴别、分离、制备等,为高考常见题型,侧重于学生的分析能力、实验能力的考查,注意把握物质的性质的异同以及实验的严密性、可行性的评价,难度不大.


科目:高中化学 来源: 题型:解答题
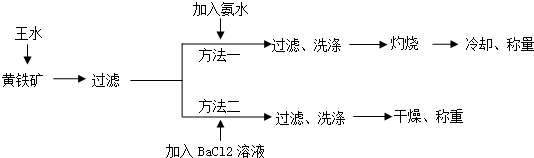
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
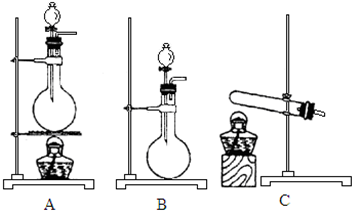
 如图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰.现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答下列问题:
如图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰.现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
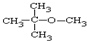 .
.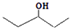 ,乙所含官能团的名称为羟基.
,乙所含官能团的名称为羟基.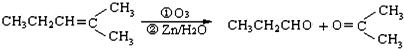
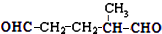 ,则烃A的结构可表示为
,则烃A的结构可表示为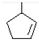 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2 800 | 2 050 | 714 | 191 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “海市蜃楼”是一种与光学和胶体性质相关的自然现象 | |
| B. | 铁制管道涂铝粉可防锈蚀 | |
| C. | 锂可用于制造质量轻、容电量大的可充电电池 | |
| D. | 焊锡中铅的作用是提高熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
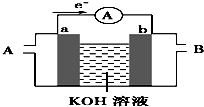 (1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压.高铁电池的总反应为:
(1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压.高铁电池的总反应为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2的漂白原理与次氯酸相同 | |
| B. | 硫在空气中燃烧生成大量SO3 | |
| C. | 金属钠应保存在水里以隔绝空气 | |
| D. | 常温下铝遇浓硫酸钝化,因此可用铝槽储运浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com