
【题目】(题文)为了探究三种气态氧化物(SO2、NO2、CO2)的性质,某同学设计了一组实验:
(1)实验一:探究三种气体在水中的溶解性,用三支相同的试管收集满三种气体,倒置在盛满水的烧杯中,一段时间后,观察到的现象如图A,B,C所示。
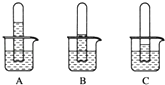
(i)在相同条件下,三种气体在水中溶解度最大的是_____,写出A烧杯中发生反应的化学方程式:________。
(2)实验二:用三只集气瓶收集满二氧化硫、二氧化氮气体,然后将其倒置在水槽中.分别缓慢通入适量O2或Cl2,如图D,E,F所示.一段时间后,D,E装置的集气瓶中充满溶液,F装置的集气瓶中还有气体剩余。
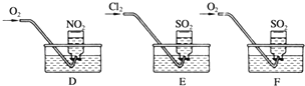
(ii)实验二中装置D的集气瓶最终充满溶液(假设瓶内液体不扩散):
①写出装置D中总反应的化学方程式:________。
②假设该实验条件下,气体摩尔体积为aLmol﹣1,则装置D的集气瓶中所得溶液溶质的物质的量浓度为_____。
(iii)实验前在F装置的水槽里滴加几滴紫色石蕊试液,观察到的现象是________,通入氧气后,可能观察到的实验现象是________,写出反应的化学方程式:________。
(iv)溶液充满集气瓶后,在E装置的水槽里滴加硝酸钡溶液,写出有关反应的离子方程式________。
【答案】NO2(或A);3NO2+H2O═2HNO3+NO4NO2+O2+2H2O═4HNO3![]() mol/L紫色石蕊试液变红;红色由浅变深2SO2+O2+2H2O=2H2SO4SO2+Cl2+2H2O=4H++SO42﹣+Cl﹣SO42﹣+Ba2+=BaSO4↓
mol/L紫色石蕊试液变红;红色由浅变深2SO2+O2+2H2O=2H2SO4SO2+Cl2+2H2O=4H++SO42﹣+Cl﹣SO42﹣+Ba2+=BaSO4↓
【解析】
(i)二氧化硫、二氧化碳的溶解度不大,而二氧化氮水发生氧化还原反应,其溶解度最大;三种气体溶于水得到的溶液均为酸溶液;(ii)①D中二氧化氮、水、氧气反应生成硝酸;②水会充满集气瓶,结合c=![]() 计算;(iii)F装置中二氧化硫与水反应生成亚硫酸,溶液显酸性,再通入氧气,发生2SO2+O2+2H2O=H2SO4,酸性增强;(iv)E装置发生SO2+Cl2+2H2O=H2SO4+2HCl,再滴加硝酸钡溶液,生成硫酸钡沉淀。
计算;(iii)F装置中二氧化硫与水反应生成亚硫酸,溶液显酸性,再通入氧气,发生2SO2+O2+2H2O=H2SO4,酸性增强;(iv)E装置发生SO2+Cl2+2H2O=H2SO4+2HCl,再滴加硝酸钡溶液,生成硫酸钡沉淀。
(1)(i)从图A、B、C的实验结果分析,试管里液面上升越高,表明相同条件下气体在水中溶解度越大;根据A中剩余气体的体积可以判断是二氧化氮溶于水发生反应生成NO:3NO2+H2O═2HNO3+NO,故答案为:NO2(或A);3NO2+H2O═2HNO3+NO;(2)(ii)①装置D中发生的反应有:3NO2+H2O═2HNO3+NO、2NO+O2═2NO2,相加得总反应方程式:4NO2+O2+2H2O═4HNO3,故答案为:4NO2+O2+2H2O═4HNO3;②水会充满集气瓶,设集气瓶体积为VL,最后溶液的体积为VL,由4NO2+O2+2H2O═4HNO3知,n(NO2)=n(HNO3),则所得溶液溶质的物质的量浓度为c=![]() =
=![]() =
=![]() mol/L,故答案为:
mol/L,故答案为:![]() mol/L;(iii)F装置中二氧化硫与水反应生成亚硫酸,溶液显酸性,滴加几滴紫色石蕊试液,观察到的现象是紫色溶液变红,再通入氧气,发生2SO2+O2+2H2O=2H2SO4,酸性增强,红色由浅变深,故答案为:紫色石蕊试液变红;红色由浅变深;2SO2+O2+2H2O=2H2SO4;(iv)E装置发生SO2+Cl2+2H2O=H2SO4+2HCl,离子反应为:SO2+Cl2+2H2O=4H++SO42﹣+Cl﹣,再滴加硝酸钡溶液,观察到生成硫酸钡白色沉淀,离子反应为:SO42﹣+Ba2+=BaSO4↓,故答案为:SO2+Cl2+2H2O=4H++SO42﹣+Cl﹣、SO42﹣+Ba2+=BaSO4↓。
mol/L;(iii)F装置中二氧化硫与水反应生成亚硫酸,溶液显酸性,滴加几滴紫色石蕊试液,观察到的现象是紫色溶液变红,再通入氧气,发生2SO2+O2+2H2O=2H2SO4,酸性增强,红色由浅变深,故答案为:紫色石蕊试液变红;红色由浅变深;2SO2+O2+2H2O=2H2SO4;(iv)E装置发生SO2+Cl2+2H2O=H2SO4+2HCl,离子反应为:SO2+Cl2+2H2O=4H++SO42﹣+Cl﹣,再滴加硝酸钡溶液,观察到生成硫酸钡白色沉淀,离子反应为:SO42﹣+Ba2+=BaSO4↓,故答案为:SO2+Cl2+2H2O=4H++SO42﹣+Cl﹣、SO42﹣+Ba2+=BaSO4↓。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】右表为元素周期表中短周期的一部分,Y元素最高正价与最低负价的代数和为4,下列叙述正确的是
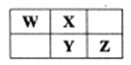
A. 原子半径: W B. 元素的非金属性:X>Y>Z
C. 氢化物的热稳定性:W>X D. 氧化物对应水化物的酸性: Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y的摩尔质量相同,Y为淡黄色固体,N常温下是液体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )
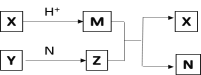
A. 相对分子质量M>N,沸点M>N
B. 原子半径:D>B>C>A
C. Z 为 NaOH
D. M是一种非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )

A. 浓H2SO4 B. NaOH溶液 C. Na2SO3溶液 D. 饱和NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是
A.32g氧气所含的原子数目为NA
B.18g水所含的电子数目为NA
C.在常温常压下11.2L氯气所含的原子数目为NA
D.2.3g金属钠变为钠离子时失去的电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~D是中学化学实验中常见的几种温度计装置示意图.
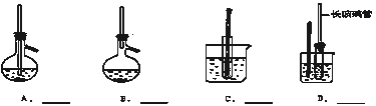
①酒清和浓硫酸混合加热制乙烯
②电石跟水反应制乙炔
③分离苯和硝基苯的混合物
④苯和溴的取代反应
⑤石油的分馏实验
⑥浓盐酸和二氧化锰混合加热制氯气
⑦测定硝酸钾在水中溶解度
⑧食盐和浓硫酸混合加热制氯化氢
⑨苯的硝化反应
(1)请从①~⑧中选出必须使用温度计的实验,把编号填入最适宜的装置图A~C的空格中。A________B________C________D________
(2)下列括号内的物质为所含的少量杂质,请选用适当的试剂和分离装置将杂质除去。
试剂:a.水,b.氢氧化钠,c.食盐,d.溴水,e.生石灰,f.溴的四氯化碳溶液
分离装置:A.分液装置,B.过滤装置,C.蒸馏装置,D.洗气装置
1﹣氯丙烷(乙醇)_____;乙烷(乙烯)_____;苯(苯酚)____;溴化钠溶液(碘化钠)____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com