
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:

(1)指出提取碘的过程中有关的实验操作名称:
①____________;写出过程②中有关反应的离子方程式: _________
(2)灼烧海带用到的仪器有_____________
(3)提取碘的过程中,可供选择的有机试剂是(____)
A .酒精 B .四氯化碳
C .甘油 D .醋酸
【答案】过滤; 2I-+Cl2=I2+2Cl-; 坩埚、酒精灯、泥三角、三脚架; B
【解析】
(1)分离固体和液体用过滤,利用溶解性的差异来分析。②中Cl2将I-氧化成I2;
(2)灼烧固体用到坩埚、酒精灯、泥三角、三脚架;
(3)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多。
(1)过滤适用于不溶于水的固体和液体,根据流程可知,分离固体海带灰和液体碘离子的溶液用过滤。②中的反应是Cl2将I-氧化成I2的反应,过程②中有关反应的离子方程式为2I-+Cl2=I2+2Cl-;
(1)灼烧海带的仪器是坩埚、用于加热的仪器是酒精灯、放置坩埚的仪器是泥三角、三脚架;
(3)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,故可用四氯化碳或苯等,酒精、醋酸、甘油等和水是互溶的,不能选择。答案选B。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( )

选项 | ① | ② | ③ | 实验结论 |
A | 稀盐酸 | CaCO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
B | 浓硫酸 | 蔗糖 | Ba(NO3)2溶液 | 验证SO2与可溶性钡盐可生成白色沉淀 |
C | 浓氨水 | 生石灰 | 酚酞溶液 | 氨气的水溶液呈碱性 |
D | 浓硝酸 | Fe | NaOH溶液 | 铁和浓硝酸反应可生成NO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用废铅蓄电池的铅泥(含PbSO4、PbO和Pb等)制备精细化工产品PbSO4·3PbO·H2O(三盐)的主要流程如下:

已知:常温下,Ksp(PbSO4)=2.0×10-8 Ksp(PbCO3)=1.0×10-13 ,请回答以下问题:
(1)铅蓄电池工作原理是PbO2+Pb+2H2SO4![]() 2PbSO4+2H2O,在放电过程中负极的质量__________;电解质溶液的pH___________(用“变大”、“不变”或“变小”填写)。该铅蓄电池放电过程中的正极反应式为__________________________________________。
2PbSO4+2H2O,在放电过程中负极的质量__________;电解质溶液的pH___________(用“变大”、“不变”或“变小”填写)。该铅蓄电池放电过程中的正极反应式为__________________________________________。
(2)步骤③的目的是使铅泥中的Pb溶解,其对应的离子方程式为________________ 。滤液2中的溶质主要是_____________(填化学式),过滤操作中使用到的玻璃仪器有_____。
(3)步骤⑥合成三盐的化学方程式为________________________。
(4)步骤⑦洗涤产品的方法是________________________________。
(5)在“转化”过程中,若PbSO4和PbCO3在悬浊液中共存,则c(SO42-):c(CO32-)=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】RO4n-离子在一定条件下可以把CI-离子氧化为ClO-,若RO4n-离子变为RO32-离子,又知反应中RO4n-与Cl-的物质的量之比为1:1,则RO4n-中R元素的化合价为 ( )
A. +4 B. +5 C. +6 D. +7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表中的周期、族的理解正确的是( )
A.元素周期表中每个纵列代表一个主族或副族
B.元素周期表中只有三个短周期
C.每个周期均从金属元素开始,到非金属元素结束
D.同一主族元素的最外层电子数可能不等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告提出要“打赢蓝天保卫战”,意味对环境污染防治比过去要求更高。
(1)烟气中的氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) H < 0 平衡常数K1
NaNO3(s)+ClNO(g) H < 0 平衡常数K1
2NO(g)+Cl2(g)![]() 2ClNO(g) H < 0 平衡常数K2
2ClNO(g) H < 0 平衡常数K2
4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=__________(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=__________(用K1、K2表示)。
(2)利用CO可将NO转化为无害的N2,其反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
在容积均为1 L的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入物质的量之比为1:1的NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
t/min n(CO) /mol | 0 | 40 | 80 | 120 | 160 |
甲 | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙 | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
丙 | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
① 甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO)=_______。
② T ___ 300℃,该反应的△H______0(填“>”或“<”)。
③ 甲容器达平衡时α(NO)=_______。
丙容器达平衡时c(NO)可能为________0.4mol/L(填“>”、“=”或“<”)。
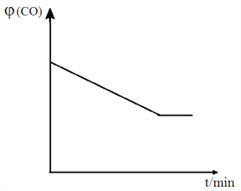
④ 已知甲容器CO的体积分数![]() (CO)随时间t的变化如图,画出其他条件不变,绝热条件下,
(CO)随时间t的变化如图,画出其他条件不变,绝热条件下, ![]() (CO)随时间t的变化示意图。_____________________
(CO)随时间t的变化示意图。_____________________
(3)处理含镉废水常用化学沉淀法。以下是几种镉的难溶化合物25℃时的溶度积常数: Ksp(CdCO3)=5.2×10-12 Ksp(CdS)=3.6×10-29 Ksp(Cd(OH)2)=2.0×10-16,
回答下列问题:
若采用生石灰处理含镉废水最佳pH为11,此时溶液中c(Cd2+)=_________。沉淀Cd2+效果最佳的试剂是____________
a.Na2CO3 b.Na2S c.CaO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过石油裂解可以获得乙烯,再以乙烯为原料还可以合成很多的化工产品,试根据下图回答有关问题:
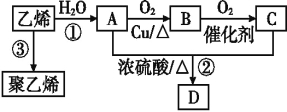
已知:有机物D是一种有水果香味的油状液体。
(1)有机物B的名称为 ,结构简式为 。
决定有机物A、C的化学特性的原子团的名称分别是 。
(2)写出图示反应②、③的化学方程式,并指明反应类型:
② ; 反应类型: 。
③ ; 反应类型: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于加成反应的是
A. CH3CH=CH2+Br2![]() CH3CHBrCH2BrB. CH3CH2OH
CH3CHBrCH2BrB. CH3CH2OH ![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
C. CH3COOH+CH3OH![]() CH3COOCH3+H2OD.
CH3COOCH3+H2OD. ![]() +HNO3
+HNO3![]()
![]() -NO2+H2O
-NO2+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com