
人体正常血红蛋白中含有Fe2+,若误食亚硝酸盐,会导致Fe2+转化为Fe3+而中毒,服用维生素C可以解毒。对上述事实的分析正确的是
A.亚硝酸盐是还原剂 B.维生素C是氧化剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐被氧化
D.亚硝酸盐被氧化
 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:选择题
| A. | 石灰石溶解在稀HCl中 CO32-+2H+═CO2↑+H2O | |
| B. | 铁屑在稀H2SO4作用下产生H2 Fe+2H+═Fe2++H2↑ | |
| C. | 金属铝溶于氢氧化钠溶液 Al+2OH-=AlO2-+H2↑ | |
| D. | 硫酸铜溶液与氢氧化钡溶液混合 Cu2++2OH-═Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
利用如图所示装置进行下列实验,将X溶液逐滴加入固体Y中,装置B的试管中的现象不正确的是( )
选项 | X溶液 | 固体Y | Z溶液 | 现象 |
|
A | 浓硫酸 | 亚硫酸氢钠 | 品红试液 | 品红褪色 | |
B | 浓氨水 | CaO | 紫色石蕊试液 | 溶液变红 | |
C | 盐酸 | 石灰石 | 硅酸钠溶液 | 出现白色沉淀 | |
D | 双氧水 | MnO2 | 氢硫酸溶液 | 产生浑浊 |
查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
下列有关“水”的说法中正确的是( )
A.双氧水被称为绿色氧化剂,是因为其还原产物为O2,对环境无污染
B.王水是浓盐酸和浓硝酸按体积比1∶3配成的混合物,可溶解Au、Pt
C.氨水能导电,说明氨气是电解质
D.往新制备的氯水中和SO2的水溶液中分别滴入石蕊试液时的现象不同
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:填空题
写出除去下列物质中杂质所选用的试剂及发生反应的离子方程式:
(1)盐酸(硫酸),试剂_________,离子方程式__________________________;
(2)NaOH(Na2CO3),试剂________,离子方程式___________ _________ ___;
(3)NaCl(CuCl2),试剂________,离子方程式_______________________ __。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
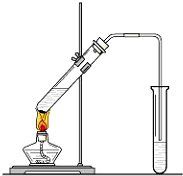 在实验室我们可以用如图所示的装置来制取乙酸乙酯.试回答下列问题:
在实验室我们可以用如图所示的装置来制取乙酸乙酯.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
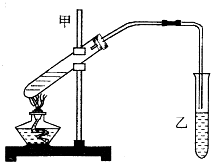 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: CH3COOC2H5+H2O.
CH3COOC2H5+H2O.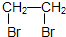 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com