
随着能源与环境问题越来越被人们关注,碳一化学成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.
Ⅰ、热化学方程式为:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol,在温度和容积相同的A、B、C三个容器中(容器的体积为2L),按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
| 容器 | A | B | C |
| 反应物投入量 | 1molCO2(g)和 3molH2(g) | 1molCH3OH(g)和 1molH2O(g) | 2molCO2(g)和6mol H2(g) |
| CH3OH(g)浓度(mol/L) | c1 | c2 | c3 |
| 反应能量变化 | 放出29.4kJ | 吸收a kJ | 放出b kJ |
①从反应开始到达平衡时,A中用CO2来表示的平均反应速率为 0.03 mol/(L•s)(用具体数值表示)
②a= 19.6 .c1 = c2 < 1/2c3(填“>”“<”或“=”).
Ⅱ、CO可用于合成甲醇.在压强0.1MPa条件下,向体积为bL的密闭容器中充入amolCO和2amolH2,在催化剂作用下合成甲醇:CO(g)+2H2(g)⇌CH3OH(g).平衡时CO的转化率与温度、压强的关系如图1所示

(1)该反应属于反应 放热 (填“吸热”或“放热”);P2 > 0.1MPa(填“>”“<”或“=”)
(2)100℃时,该反应的平衡常数K= 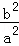 (用含a、b的代数式表示)
(用含a、b的代数式表示)
Ⅲ、碳一化合物在治理汽车尾气方面也大有可为,如CO、CH4等在一定条件下均可以与氮氧化物生成无污染的物质.CO与NO在催化剂的条件下反应如下:2NO(g)+2CO(g)⇌2CO2(g)+N2(g)△H<0,在绝热、恒容的密闭容器中加入一定量的NO和CO发生上述反应,图2的示意图不能说明反应在进行到t1时刻达到平衡状态的是 c (填字母序号)
考点: 化学平衡的计算;化学平衡状态的判断;等效平衡.
专题: 化学平衡专题.
分析: Ⅰ、①根据A中达到平衡时放热热量计算出消耗二氧化碳的物质的量,再根据c=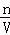 、v=
、v=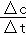 计算出反应速率;
计算出反应速率;
②恒温恒容下,容器A与容器B为等效平衡,平衡时对应组分的物质的量、浓度相等,二者起始物质的量等于各物质的化学计量数,放出热量与吸收热量之和等于反应热数值;而C中初始反应物为A的2倍,相当于增大了压强,平衡向着正向移动,据此判断达到平衡时甲醇的浓度;
Ⅱ、(1)根据图象中曲线变化及温度、压强对化学平衡的影响判断;
(2)利用三段式计算出平衡时各组分的物质的量,进而求出平衡时各组分的浓度,代入平衡常数表达式计算;
Ⅲ、可逆反应达到平衡状态时,正逆反应速率相等,各组分浓度不再变化,据此进行判断.
解答: Ⅰ、①1mol二氧化碳完全反应放出49.0kJ热量,当放出29.4kJ热量时,则参加反应的二氧化碳为:n(CO2)=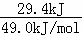 =0.6mol,CO2的浓度变化为:△c=
=0.6mol,CO2的浓度变化为:△c=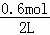 =0.3mol/L,二氧化碳的平均反应速率为:v(CO2)=
=0.3mol/L,二氧化碳的平均反应速率为:v(CO2)=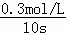 =0.03mol/(L•s),
=0.03mol/(L•s),
故答案为:0.03;
②恒温恒容下,容器A与容器B为等效平衡,平衡时对应组分的物质的量、浓度相等,则c1=c2,二者起始物质的量等于各物质的化学计量数,放出热量与吸收热量之和等于反应热数值,则吸收的热量=反应热﹣放出的热量=49.0kJ﹣29.4kJ=19.6kJ;由于C中初始反应物为A的2倍,则与A相比相当于增大压强,平衡向着正向移动,则C中甲醇浓度增大,即:C中甲醇的浓度大于A的2倍:c1=c2<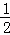 c3,
c3,
故答案为:19.6;=;<;
Ⅱ、(1)由图可知,压强一定时,随温度升高,CO的转化率降低,故升高温度平衡向逆反应移动,则正反应为放热反应;
当温度相同时,压强为P2时CO的转化率增大,该反应是气体体积缩小的反应,增大压强平衡向着正向移动,CO转化率增大,则P2>0.1MPa,
故答案为:放热;>;
(2)根据图象可知100℃时平衡时CO的转化率为0.5,所以参加反应的CO的物质的量为0.5amol.
CO(g)+2H2(g)⇌CH3OH(g);
开始(mol):a 2a 0
变化(mol):0.5a a 0.5a
平衡(mol):0.5a a 0.5a
平衡(mol)0.5a a 0.5a
则达到平衡时各组分浓度为:c(CO)=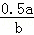 mol/L、c(H2)=
mol/L、c(H2)=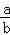 mol/L、c(CH3OH)=
mol/L、c(CH3OH)=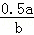 mol/L,
mol/L,
100℃时该反应的平衡常数为:K=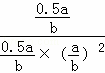 =
=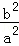 ,
,
故答案为: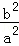 ;
;
Ⅲ、当反应前后改变的物理量不变时,该可逆反应达到平衡状态,
a中为平衡常数,平衡常数与温度有关,温度不变,则平衡常数始终不变,所以平衡常数不能判断是否达到平衡状态,故a错误;
b为物质的量随时间的变化,一氧化氮与二氧化碳浓度相等时,各组分浓度仍然继续变化,说明没有达到平衡状态,故b错误;
c为CO质量分数随时间变化,反应恰好总质量不变,则反应过程中CO质量分数会发生变化,当达到平衡状态时,CO的质量分数不再变化,故c正确;
故答案为:c.
点评: 本题考查了化学平衡、化学反应速率的计算、化学平衡状态的判断,题目难度较大,注意掌握化学平衡常数、化学反应速率的能够及计算方法,明确化学平衡状态的判断方法,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学计算能力.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡,混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)该反应的离子方程式为 ;
(2)探究温度对化学反应速率影响的实验编号是 (填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是 ;
(3)实验①测得KMn04溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMn04)= mol·L-1·min-1;
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25℃时c(Mn04-)~t的变化曲线示意图。

查看答案和解析>>
科目:高中化学 来源: 题型:
下列图示与对应的叙述相符的是( )
|
| A. | 图甲可以判断出反应A(g)+B(g)⇌若2C(g)的△H<0,T2>T1 |
|
| B. | 图乙表示压强对可逆反应2A(g)+2B(g)⇌3C(g)+D(s)的影响.乙的压强比甲的压强大 |
|
| C. | 依据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO,调节pH≈4 |
|
| D. | 图丁表示25℃时,用0.1 mol/L叫盐酸滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入盐酸体积的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度条件下,甲、乙两个容积相等的恒容密闭容器中均发生如下反应:3A(g)+B(g)⇌xC(g)+D(s),向甲中通入6mol A和2mol B,向乙中通入1.5mol A、0.5mol B和3mol C和2mol D,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,下列叙述中正确的是( )
|
| A. | 若平衡时,甲、乙两容器中A的物质的量不相等,则x=4 |
|
| B. | 平衡时,甲、乙两容器中A、B的物质的量之比不相等 |
|
| C. | 平衡时甲中A的体积分数为40% |
|
| D. | 若平衡时两容器中的压强不相等,则两容器中压强之比为8:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式书写正确的是( )
|
| A. | 2SO2+O2 |
|
| B. | C(s)+O2(g)═CO2(g)△H=+393.5 kJ/mol |
|
| C. | 500℃、30MPa下,将0.5mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) |
|
| D. | 2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体,放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣2589.6kJ/moL |
查看答案和解析>>
科目:高中化学 来源: 题型:
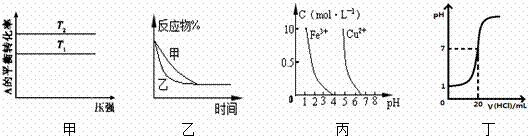
对下列实验的描述正确的是( )
|
| A. | 图1所示的实验:根据电流计(G)中指针是否偏转即可比较Zn、Cu的金属活泼性 |
|
| B. | 图2所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀 |
|
| C. | 图3所示的实验:根据温度计读数的变化测定稀硫酸和NaOH溶液反应的反应热 |
|
| D. | 图4所示的实验:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)判断2NO2(g)⇌N2O4(g)是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
W、X,Y,Z均为短周期元素,X,Y处于同一周期,X,Z的最低价离子分别为X2﹣和Z﹣,Y+和Z﹣具有相同的电子层结构.下列说法正确的是( )
|
| A. | 原子最外层电子数:X>Y>Z | B. | 单质沸点:X>Y>Z |
|
| C. | 离子半径:X2﹣>Y+>Z﹣ | D. | 原子序数:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某种兴奋剂的结构简式如图所示,
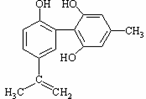
有关该物质的说法中正确的是( )
A.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
B.滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
C.1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4mol和7mol
D.该分子中的所有碳原子不可能共平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com