
【题目】高聚物H是一种光刻胶,其中的一种合成路线如下:

回答下列问题:
(1)B的化学名称是_________。
(2)B生成C的反应类型为_________,F与G反应生成H的反应类型为_________。
(3)H中官能团的名称为___________________________。
(4)C的结构简式为__________________,G的结构简式为__________________。
(5)已知E与D,F与CH3OH分别含有相同的官能团,写出D与CH3OH反应生成E和F的化学方程式:________。
(6)芳香族化合物X是G的同分异构体,1 mol X与足量银氨溶液反应生成4 mol Ag,则X的结构简式有_____(不考虑立体异构)种,写出核磁共振氢谱显示有五种不同化学环境的氢,且峰面积之比为1:2:2:2:1的X的结构简式:___________(任写一种)。
【答案】乙炔 加成反应 取代反应(或酯化反应) 碳碳双键、酯基 CH3COOCH=CH2 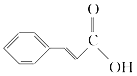
![]() 10
10 ![]() (或
(或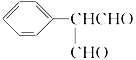 )
)
【解析】
根据合成路线可推出:C为CH3COOCH=CH2;E为CH3COOCH3;F为 ;G为
;G为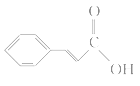 。
。
(1)B是乙炔,故答案为:乙炔。
(2)C2H2和CH3COOH反应生成C4H6O2,结构简式为CH3COOCH=CH2,可知为加成反应;F与G反应生成H,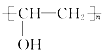 和
和 生成
生成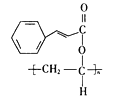 ,H中有酯基生成,故发生酯化反应,故答案为:加成反应;取代反应(或酯化反应)。
,H中有酯基生成,故发生酯化反应,故答案为:加成反应;取代反应(或酯化反应)。
(3) 中官能团的名称为碳碳双键、酯基,故答案为:碳碳双键、酯基。
中官能团的名称为碳碳双键、酯基,故答案为:碳碳双键、酯基。
(4)C2H2和CH3COOH发生加成反应生成C,C结构简式为CH3COOCH=CH2;F与G反应生成H,发生的是酯化反应,故G的结构简式为 ,故答案为:CH3COOCH=CH2;
,故答案为:CH3COOCH=CH2; 。
。
(5)D与CH3OH反应生成E和F的化学方程式:
![]() ,故答案为:
,故答案为:![]() 。
。
(6)芳香族化合物X是G的同分异构体,1 mol X与足量银氨溶液反应生成4 mol Ag,X中应含有2个醛基,先在苯环上按邻、间、对固定醛基,再放甲基,共6种;![]() ,邻、间、对共3种;再加上
,邻、间、对共3种;再加上 ,一共10种,核磁共振氢谱显示有五种不同化学环境的氢,且峰面积之比为1:2:2:2:1的X的结构简式为:
,一共10种,核磁共振氢谱显示有五种不同化学环境的氢,且峰面积之比为1:2:2:2:1的X的结构简式为:![]() (或
(或 ),故答案:10;
),故答案:10;![]() (或
(或 )。
)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Na+、Al3+、Cl-、SO42-四种离子,已知前三种离子的个数比为3∶1∶2,则溶液中Al3+ 和SO42-的离子个数比为
A. 1∶2 B. 1∶4 C. 3∶4 D. 3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测不合理的是

A. Fe2+的氧化率随时间延长而逐渐增大
B. 由②和③可知,pH越大,Fe2+氧化速率越快
C. 由①和③可知,温度越高,Fe2+氧化速率越快
D. 氧化过程的离子方程式为:4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、Cu及其相关化合物用途非常广泛。回答下列问题:
(1)基态铜原子的价电子排布式为__________________。
(2)铜与钾处于同周期且最外层电子数相同,铜的熔沸点及硬度均比钾大,其原因是___________________________。
(3)NH3分子的立体构型为_________,中心原子的杂化类型是_________。
(4)N、S、P是组成蛋白质的常见元素。三种元素中第一电离能最大的是_________,电负性最小的是_________。(填元素符号)
(5)已知:Cu2O熔点为1235℃,CuCl熔点为426℃,则可判定Cu2O为_________ (填“离子晶体”或“分子晶体”,下同),CuCl为_________。
(6)氮与铜形成的一种化合物的晶胞结构如图所示。
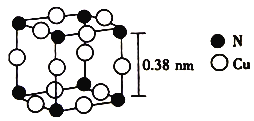
与每个Cu原子紧邻的Cu原子有_________个,阿伏加德罗常数的数值为NA,该晶体的密度为_________ (列出计算式)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水资源的利用具有广阔的前景。从海水中提取Br2与MgCl2 6H2O的流程如下:
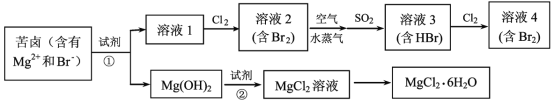
(1)写出一种海水淡化的方法_____。
(2)比较溶液中Br2的浓度:溶液2_____溶液4(填“>”或“<”)。
(3)鼓入空气与水蒸气将Br2吹出,吹出的气体用SO2吸收,其化学方程式是_______。
(4)试剂①可以选用__________,加入试剂②后反应的离子方程式是_________。
(5)从MgCl2溶液获得MgCl2 6H2O晶体的主要操作包括_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效氧化、杀菌及漂白剂,其生产工艺如下:
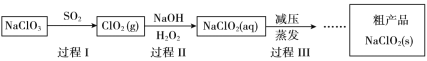
(1)NaClO2中氯元素的化合价是_________。从氧化还原角度推测NaClO2可能具有的化学性质是_________。
(2)过程I常伴有少量Cl2生成。
① Cl2的存在会造成产品中含有NaCl,请结合离子方程式解释其原因_________。
② 结合下面信息,请设计实验方案除去ClO2中的Cl2 ________。
ClO2 | Cl2 | |
在水中的溶解性 | 易溶 | 溶 |
在CCl4中的溶解性 | 难溶 | 溶 |
(3)过程II中H2O2的作用是________(填“氧化剂”或“还原剂”)。
(4)理论上每生成1 mol NaClO2,消耗SO2的体积是________L(标准状况下)。
(5)已知:
i. 压强越大,物质的沸点越高。
ii. NaClO2饱和溶液在温度低于38℃时析出NaClO23H2O
38~60℃时析出NaClO2晶体
高于60℃时分解成NaClO3和NaCl
① 过程III采用“减压蒸发”操作的原因是_____。
② 请将过程III的操作补充完整_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室采用如图所示装置制备乙酸乙酯,实验结束后,取下盛有饱和碳酸钠溶液的试管,再沿该试管内壁缓缓加入紫色石蕊试液1毫升,发现紫色石蕊试液存在于饱和碳酸钠溶液层与乙酸乙酯液层之间(整个过程不振荡试管),下列有关该实验的描述,正确的是( )

A. 制备的乙酸乙酯中没有杂质
B. 该实验中浓硫酸的作用是催化剂和脱水剂
C. 石蕊层为三层环,由上而下是蓝、紫、红
D. 饱和碳酸钠溶液主要作用是降低乙酸乙酯的溶解度及吸收乙醇、中和乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的Mg、Al的混合物中加入足量盐酸,产生标准状况下的气体5.6L,再在此溶液中加入过量NaOH溶液,产生沉淀5.8克,求:
(1)Mg、Al的物质的量各为多少_________?
(2)若将此混合物投入足量的NaOH溶液中,求标准状况下产生气体的体积_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com