
下列实验操作和现象对应所得到的结论均正确的是
选项 | 实验操作和现象 | 结论 |
A | 向某无色溶液中滴加氯水和CCl4,振荡、静置,下层溶液显紫色 | 原溶液中有I- |
B | 向稀HNO3中加入过量的Fe粉,充分反应后,滴入K3[Fe(CN)6]溶液,产生蓝色沉淀 | 稀HNO3将Fe氧化为Fe2+ |
C | 常温下,测定盐酸和醋酸溶液的pH;盐酸pH小于醋酸PH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
D | 室温下,用pH试纸测得:0.1mol/LNa2SO3溶液的pH约为10;0.1mol/ LNaHSO3溶液的pH约为5 | HSO3-结合H+的能力比SO32-的强 |
A. A B. B C. C D. D
科目:高中化学 来源:2016-2017学年山东省高二3月月考化学试卷(解析版) 题型:选择题
下列实验能达到预期目的是( )
A. 检验溴乙烷中的溴原子:将溴乙烷与过量NaOH溶液混合加热后,滴加AgNO3溶液
B. 配制银氨溶液:在稀的AgNO3溶液中滴加稀氨水至恰好完全沉淀为止。
C. 检验淀粉是否水【解析】
向淀粉溶液中加入稀硫酸加热,充分水解后加入新制的Cu(OH)2悬浊液检验。
D. 检验CH2=CHCHO中官能团:先加入新制氢氧化铜,加热观察现象,酸化后再加入溴水观察。
查看答案和解析>>
科目:高中化学 来源:2017届北京市海淀区高三3月适应性考试(零模)理综化学试卷(解析版) 题型:实验题
某实验小组探究少量Cl2和FeBr2反应的过程。
(1)配制FeBr2溶液:
ⅰ.配制50mL1.0mol/LFeBr2溶液;
ⅱ.上述溶液呈淡黄色。取少量此溶液,向其中滴入KSCN溶液,变为浅红色。
①配制50mL1.0mol/LFeBr2溶液需要的玻璃容器是________________。
②由ⅱ可知,此FeBr2溶液呈黄色的原因是其中含有________,用离子方程式解释产生其原因:_______。
(2)氯气和FeBr2反应实验操作及现象如下:
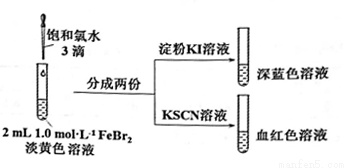
据此甲同学得出结论:少量Cl2既能和Fe2+又能和Br-发生氧化还原反应。
①Cl2和Fe2+发生反应的离子方程式是________________。
②乙同学认为上述实验不能证明Cl2和Br-发生反应,理由是_____________。
③乙同学改进实验如下:在上述FeBr2溶液中加入过量铁粉,取上清液2 mL,向其中滴加3滴饱和氯水后,再加入CCl4,振荡后静置,观察现象。乙得出结论:少量Cl2只与Fe2+反应,不与Br-反应。乙得出该结论依据的实验现象是____________________。
(3)丙同学继续设计实验,探究反应过程:
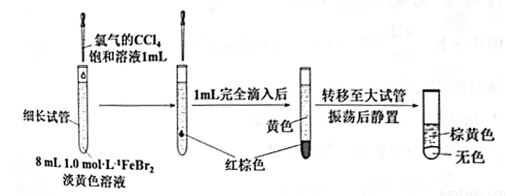
①转移到大试管前CCl4液体中呈红棕色的物质是___________。
②丙通过此实验可得出结论:________。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省新联考高三第四次联考理科综合化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W的原子序数依次增大,X、W处于同一主族。Z、W形成的常见离子Z2-和W+,且二者具有相同的电子层结构。X与Y、Z组成的等电子离子YX4-、ZX-能发生反应,生成物质甲和乙。下列说法不正确的是
A. 物质甲和乙所含的电子数相同
B. 最外层电子数:Y>Z>X
C. 原子半径r(W)>r(Y)>r(Z)
D. Y、Z分别与X形成简单化合物的稳定性:Z>Y
查看答案和解析>>
科目:高中化学 来源:辽宁省葫芦岛市高三第一次模拟考试理综化学试卷 题型:填空题
金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)Ti基态原子的电子排布式为____________。
(2)Ti能与B、C、N、O等非金属元素形成稳定的化合物,B、C、N的电负性由大到小的顺序为_____;C、N、O的第一电离能由大到小的顺序为_____________。
(3)N的氢化物常作制冷剂,原因是______________。
(4)月球岩石—玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。
SO42-的空间构型为_______形。其中硫原子采用_________杂化,写出SO42-的一种等电子体的化学式:______。
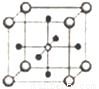
(5)Ti、Ca、O相互作用能形成如图晶体结构(Ti4+位于立方体的顶点、Ca2+位于立方体体心),该晶体的化学式为________。Ti4+和周围_____个O2-相紧邻。该晶胞的边长为apm,则其密度为______g/cm3。
查看答案和解析>>
科目:高中化学 来源:辽宁省葫芦岛市高三第一次模拟考试理综化学试卷 题型:选择题
下列说法不正确的是
A. 石英是制造光导纤维的原料,也是常用的半导体材料
B. 氧化铝是冶炼金属铝的原料,也是较好的耐火材料
C. 天然氨基酸能溶于强碱或强酸溶液,是两性化合物
D. 船舶外壳装上锌块,是牺牲阳极的阴极保护法进行防腐
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏省高二下学期第一次月考化学试卷(解析版) 题型:选择题
在1s、2px、2py、2pz轨道中,具有球对称性的是( )。
A. 1s B. 2px C. 2py D. 2pz
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏省高二下学期第一次月考化学试卷(解析版) 题型:选择题
一定温度,可逆反应2NO2 2NO+O2在体积固定的密闭容器中反应,达到平衡状态标志是
2NO+O2在体积固定的密闭容器中反应,达到平衡状态标志是
①单位时间内生成n mol O2 ,同时生成2n mol NO2
②单位时间内生成n mol O2 ,同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2 :2 :1
④混合气体的压强不再改变
⑤混合气体的颜色不再改变
⑥混合气体的平均摩尔质量不再改变
A.①④⑤⑥ B.①②③⑤ C.②③④⑥ D.以上全部
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省襄阳市高二3月月考化学试卷(解析版) 题型:选择题
有机物A、B、C、D、E都是常见的有机物,能发生如图所示的转化,已知A的分子式为C10H20O2,则符合此转化关系的A的可能结构有 ( )
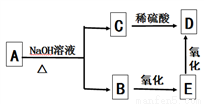
A. 3种 B. 8种 C. 4种 D. 16种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com