
【题目】硫代硫酸钠在纺织业等领域有广泛应用。某兴趣小组用下图装置制备![]() 。
。

合成反应:![]()
![]()
![]()
滴定反应:![]()
已知:![]() 易溶于水,难溶于乙醇,
易溶于水,难溶于乙醇,![]() 开始失结晶水。
开始失结晶水。
实验步骤:
Ⅰ.![]() 制备:装置A制备的
制备:装置A制备的![]() 经过单向阀通入装置C中的混合溶液,加热、搅拌,至溶液
经过单向阀通入装置C中的混合溶液,加热、搅拌,至溶液![]() 约为7时,停止通入
约为7时,停止通入![]() 气体,得产品混合溶液。
气体,得产品混合溶液。
Ⅱ.产品分离提纯:产品混合溶液经蒸发浓缩、冷却结晶、过滤洗涤、干燥,得到![]() 产品。
产品。
Ⅲ.产品纯度测定:以淀粉作指示剂,用![]() 产品配制的溶液滴定碘标准溶液至滴定终点,计算
产品配制的溶液滴定碘标准溶液至滴定终点,计算![]() 含量。
含量。
请回答:
(1)步骤Ⅰ:单向阀的作用是______;装置C中的反应混合溶液![]() 过高或过低将导致产率降低,原因是_______。
过高或过低将导致产率降低,原因是_______。
(2)步骤Ⅱ:下列说法正确的是_____。
A 快速蒸发溶液中水分,可得较大晶体颗粒
B 蒸发浓缩至溶液表面出现品晶膜时,停止加热
C 冷却结晶后的固液混合物中加入乙醇可提高产率
D 可选用冷的![]() 溶液作洗涤剂
溶液作洗涤剂
(3)步骤Ⅲ
①滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):
检漏→蒸馏水洗涤→(______)→(______)→(______)→(______)→(______)→开始滴定。
A 烘干 B 装入滴定液至零刻度以上 C 调整滴定液液面至零刻度或零刻度以下D 用洗耳球吹出润洗液 E 排除气泡 F 用滴定液润洗2至3次 G 记录起始读数
②装标准碘溶液的碘量瓶(带瓶塞的锥形瓶)在滴定前应盖上瓶塞,目的是______。
③滴定法测得产品中![]() 含量为
含量为![]() ,则
,则![]() 产品中可能混有的物质是________。
产品中可能混有的物质是________。
【答案】防止倒吸 ![]() 过高,
过高,![]() 、
、![]() 反应不充分;
反应不充分;![]() 过低,导致
过低,导致![]() 转化为S和
转化为S和![]() BC F B E C G
BC F B E C G
防止碘挥发损失 ![]() 、失去部分结晶水的
、失去部分结晶水的![]()
【解析】
本实验的目的是制备Na2S2O3·5H2O,首先装置A中利用浓硫酸和亚硫酸钠固体反应生成二氧化硫,将SO2通入装置C中的混合溶液,加热搅拌,发生题目所给合成反应,使用单向阀可以防止倒吸;为了使Na2CO3、Na2S充分反应,同时又不因酸性过强使Na2S2O3发生歧化反应,至溶液pH约为7时,停止通入SO2气体,得到产品的混合溶液;之后经蒸发浓缩,冷却结晶、过滤、洗涤、干燥得到产品,已知Na2S2O3·5H2O难溶于乙醇,冷却结晶后可以加入适量乙醇降低Na2S2O3的溶解度,析出更多的晶体。
(1)SO2会与装置C中混合溶液发生反应,且导管进入液面以下,需要防倒吸的装置,单向阀可以防止发生倒吸;Na2CO3、Na2S水解都会使溶液显碱性,所以pH过高,说明Na2CO3、Na2S反应不充分;而pH过低,又会导致Na2S2O3发生歧化反应转化为S和SO2,所以pH过高或过低都会导致产率降低;
(2)A.蒸发结晶时,快速蒸发溶液中的水分,可以得到较小的晶体颗粒,故A错误;
B.为防止固体飞溅,蒸发浓缩至溶液表面出现晶膜时,停止加热,故B正确;
C.Na2S2O3·5H2O难溶于乙醇,所以冷却结晶后的固液混合物中可以加入适量乙醇降低Na2S2O3的溶解度,析出更多的晶体,提高产率,故C正确;
D.用碳酸钠溶液洗涤会使晶体表面附着碳酸钠杂质,Na2S2O3·5H2O难溶于乙醇,可以用乙醇作洗涤剂,故D错误;
综上所述选BC;
(3)①滴定前应检查滴定管是否漏液,之后用蒸馏水洗涤滴定管,为防止稀释滴定液使测定结果不准确,需用滴定液润洗2至3次,之后装入滴定液至零刻度以上,排除装置中的气泡,然后调整滴定液液面至零刻度或零刻度以下,并记录起始读数,开始滴定,所以正确的操作和顺序为:捡漏→蒸馏水洗涤→F→B→E→C→G→开始滴定;
②碘容易挥发,所以装标准碘溶液的碘量瓶在滴定前应盖上瓶塞,防止碘挥发损失;
③测定的产品中Na2S2O3·5H2O含量大于100%,说明产品中混有失去部分结晶水的Na2S2O3·5H2O。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 把100 mL 3 mol·L-1的H2SO4跟100 mL H2O混合,硫酸的物质的量浓度为1.5 mol·L-1
B. 把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10%
C. 把200 mL 3 mol·L-1的BaCl2溶液跟100 mL 3 mol·L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol·L-1
D. 把100 mL 20%的NaOH溶液跟100 mL H2O混合后,NaOH溶液的质量分数是10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 
D. H2O的电子式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应:A(s)+2B(g)![]() C(g)+D(g)已达平衡的是( )
C(g)+D(g)已达平衡的是( )
A. 混合气体的压强B. 混合气体密度
C. A的物质的量浓度保持不变D. 气体总物质的量保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是

A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e--=4OH--
C. 每转移0.1mol电子,消耗1.12L的H2
D. H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用质量分数为98%、密度为1.84 g·cm-3的浓H2SO4来配制500 mL、0.2 mol·L-1的稀H2SO4。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有__________(填代号)。
(2)经计算,需浓H2SO4的体积为____________。现有①10 mL ②50 mL ③100 mL三种规格的量筒,你选用的量筒是__________(填代号)。
(3)将浓H2SO4加适量蒸馏水稀释后,冷却片刻,随后全部转移到__________ mL的容量瓶中,转移时应用玻璃棒__________。转移完毕,用少量蒸馏水洗涤__________2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀。然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度__________处。改用__________加蒸馏水到瓶颈刻度的地方,使溶液的__________。振荡、摇匀后,装瓶、贴签。
(4)在配制过程中,其他操作都准确,下列操作中:错误的是_______,能引起误差偏高的有______(填代号)。
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肯定属于同族元素且性质相似的是( )
A.原子核外电子排布式:A为1s22s2,B为1s2
B.结构示意图:A为![]() ,B为
,B为
C.A原子基态时2p轨道上有1个未成对电子,B原子基态时3p轨道上有1个未成对电子
D.A原子基态时3p轨道上有一对成对电子,B原子基态时4p轨道上也有一对成对电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是
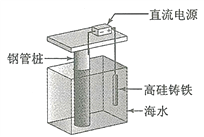
A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子。Y元素原子的最外层2p轨道上有2个未成对电子,X跟Y可形成化合物X2Y3。Z元素可以形成负一价离子。请回答下列问题:
(1)X元素基态原子的电子排布式为_________,该元素的符号是____。
(2)Y元素原子的价层电子排布图为_________,该元素的名称是____。
(3)已知化合物X2Y3在稀硫酸中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com