
| A. | 为了防止食品受潮及富脂食品氧化变质,常在包装袋中放入硅胶和硫酸亚铁( ) | |
| B. | 积极推行和使用能被微生物降解的新型聚合物材料 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 废旧电池应集中回收,不能填埋处理 |
分析 A.根据硅胶和硫酸亚铁的性质分析;
B.积极推行和使用能被微生物降解的新型聚合材料,可以减少白色污染;
C.依据绿色化学的核心解答;
D.根据废旧电池所含的少量的重金属对人体有害,应该集中回收处理判断.
解答 解:A.为了防止食品受潮及氧化变质,一般防受潮放硅胶,防氧化腐烂变质应放还原铁粉或亚铁盐,故A正确;
B.积极推行和使用能被微生物降解的新型聚合材料,可以减少白色污染,利于节能减排、改善环境质量,故B正确;
C.绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染,故C错误;
D.废旧电池所含的少量的重金属对人体有害,应该集中回收处理,不能填埋处理,故D正确;
故选:C.
点评 本题考查了化学与生活,设计食品的保存、环境污染与治理,明确物质的性质是解题关键,注意对相关知识的积累,题目难度不大.


科目:高中化学 来源: 题型:解答题
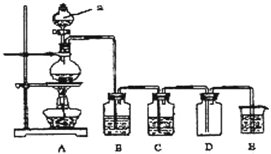 如图是实验室中制备气体或验证气体性质的装置图
如图是实验室中制备气体或验证气体性质的装置图查看答案和解析>>
科目:高中化学 来源: 题型:解答题
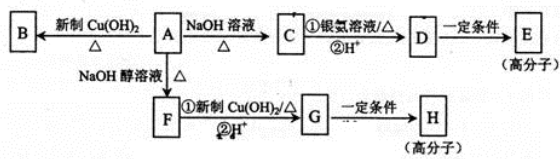
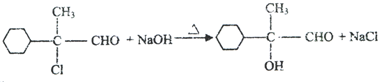 .
.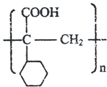 ,E的结构简式是
,E的结构简式是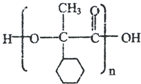 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:2Mn2++5S2O82-+8H2O$\frac{\underline{\;Ag+\;}}{\;}$2MnO4-+10SO42-+16H+
钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:2Mn2++5S2O82-+8H2O$\frac{\underline{\;Ag+\;}}{\;}$2MnO4-+10SO42-+16H+查看答案和解析>>
科目:高中化学 来源: 题型:解答题
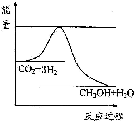 以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.
以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.| 起始 浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| X | Y | Z | |
| 第一电离能(KJ/mol) | 526.2 | 502.8 | 425.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com