
| 城市 | 污染指数 | 首要污染物 | 空气质量等级 | ||
| SO2 | NO2 | PM10 | |||
| A | 98 | 23 | 67 | SO2 | Ⅱ |
| B | 47 | 29 | 35 | SO2 | Ⅰ |
| C | 62 | 80 | 113 | PM10 | Ⅲ |
| D | 52 | 76 | 59 | NO2 | Ⅰ |
分析 (1)依据图表分析空气质量日报涉及的污染物;酸雨的形成主要是二氧化硫污染指数;
(2)汽车尾气主要是氮氧化物和一氧化碳,在催化剂作用下反应生成二氧化碳和氮气;
(3)①用足量的氢氧化钠溶液吸收含二氧化硫的工业废气,反应生成亚硫酸钠和水;
②亚硫酸被空气中氧气氧化生成硫酸.
解答 解:(1)分析图表预报物质和数据可知涉及的污染物主要是二氧化硫、二氧化氮、可吸入颗粒物,分析污染物含量可知二氧化硫含量A最高,易形成酸雨;
故答案为:SO2、NO2;A;
(2)治理方法之一是在汽车排气管上加装“催化转化器”,使CO与NOx反应生成可参与大气生态环境循环的无毒气体为氮气和二氧化碳气体;
故答案为:CO2、N2;
(3)①若用足量的氢氧化钠溶液吸收含二氧化硫的工业废气,该反应的化学反应方程式为SO2+2NaOH=Na2SO3+H2O;
故答案为:SO2+2NaOH=Na2SO3+H2O;
②若将含二氧化硫的废气通入水中,在一段时间内连续不断测定溶液的pH值,发现pH值变小,这是由于空气中的氧气氧化亚硫酸生成硫酸,反应的化学方程式为:2H2SO3+O2=2H2SO4,
故答案为:2H2SO3+O2=2H2SO4.
点评 本题考查了数据分析判断、物质性质、化学方程式书写,二氧化硫的性质分析是解题关键,题目难度不大.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 平衡向逆反应方向移动了 | B. | 物质A的转化率增大 | ||
| C. | 物质C的质量分数增大 | D. | m>2n |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
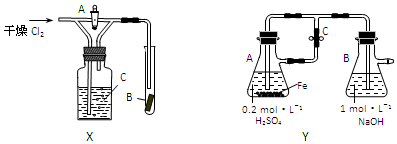
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,CuS的溶解度大于ZnS的溶解度 | |
| B. | 25℃时,向含有等物质的量的FeCl2、CuCl2的混合液中逐滴加入Na2S,最先出现沉淀的是FeS | |
| C. | 除去ZnCl2溶液中的Cu2+,可以选用FeS作沉淀剂 | |
| D. | 将足量CuSO4溶解在0.1 mol/L的H2S溶液中,S2-能达到的最大浓度为$\sqrt{1.3}$×10-18mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上常通过电解熔融的MgO冶炼金属镁 | |
| B. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| C. | 用惰性电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1:2 | |
| D. | 已知:①2H2(g)+O2(g)=2H2O(g)△H=-aKJ/mol ②2H2(g)+O2(g)═2H2O(l)△H=-bKJ/mol△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)估计下列各变化过程是熵增还是熵减.
(1)估计下列各变化过程是熵增还是熵减.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe3+、SO42-、NO3- | B. | Na+、K+、Br -、AlO2- | ||
| C. | Na+、NO3-、Cl-、SO42- | D. | Na+、K+、I-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下电离常数为Ka的酸HA溶液中c(H+)$\sqrt{{K}_{a}}$mol•L-1 | |
| B. | 向0.1 mol•L-1的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| C. | 0.2 mol•L-1CH3COOH溶液与0.1 mol•L-1NaOH溶液等体积混合:2c(H+)-2 c(OH-)═c(CH3COO-)-c(CH3COOH) | |
| D. | 将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com