
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是形成酸雨的主要气体之一;Z基态原子的M层与K层电子数相等;R2+的3d轨道有9个电子.请回答下列问题:
X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是形成酸雨的主要气体之一;Z基态原子的M层与K层电子数相等;R2+的3d轨道有9个电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
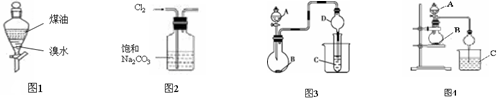 ( )
( )| A. | 利用图1完成“用煤油来萃取溴水中的Br2”,充分振荡后静置,上层变橙红色,下层几乎无色 | |
| B. | 实验室制取纯净Cl2,可用图2装置除去Cl2中的HCl气体杂质 | |
| C. | 图3中,若A、B、C分别为浓硫酸、Na2SO3固体、石蕊溶液,则C中溶液先变红后褪色 | |
| D. | 图4中,若A为浓氨水,B为生石灰,C硝酸银稀溶液,实验中可看到C中先变浑浊后变澄清,说明AgOH具有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| 物 质 | 样 品 | 消耗稀盐酸质量 | 反应后溶液质量 |
| 质量(g) | 9 | 75.4 | 80 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有1molHCl的浓盐酸与足量的MnO2反应,收集的氯气为22.4L(标准状况) | |
| B. | 含SO2的乙烯依次通入足量的NaOH溶液、酸性KMnO4溶液,可检验乙烯的还原性 | |
| C. | 制备乙酸乙酯时,将生成物通入饱和Na2CO3溶液中,除去杂质乙酸、乙醇 | |
| D. | 中和热测定实验、用温度计测量温度和搅拌,可减少热量散失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{100c}{a+b}$% | B. | $\frac{a}{a+b+c}$×100% | C. | $\frac{100c}{a+b-c}$% | D. | $\frac{100c}{a+b-\frac{c}{2}}$% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
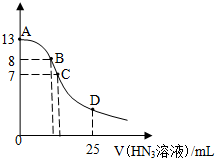 常温下向25mL0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1的HN3溶液(叠氮酸),pH的变化曲线如图所示(溶液混合时体积的变化忽略不计,叠氮酸的Ka=10-4.7).下列说法正确的是( )
常温下向25mL0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1的HN3溶液(叠氮酸),pH的变化曲线如图所示(溶液混合时体积的变化忽略不计,叠氮酸的Ka=10-4.7).下列说法正确的是( )| A. | A点水电离出的c(H+)小于B点 | |
| B. | 在B点,离子浓度大小为 c(OH-)>c(H+)>c(Na+)>c(N3-) | |
| C. | 在C点,滴加的V(HN3)=12.5mL | |
| D. | 在D点,c(H+)≈10-4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
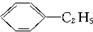 )的方法中,原子经济性最好的是(反应均在一定条件下进行)( )
)的方法中,原子经济性最好的是(反应均在一定条件下进行)( )| A. | 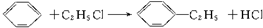 | B. |  | ||
| C. | 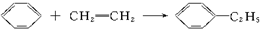 | D. |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com