

| A、原子半径:Z>Y>X |
| B、R元素的含氧酸和W元素的含氧酸,酸性一定前者强 |
| C、X和Z形成的化合物能溶于NaOH溶液 |
| D、Y和W形成的化合物中,阴阳离子的个数可能比为1:1 |


科目:高中化学 来源: 题型:
| A、1mol Cl2通入含有2mol FeI2的溶液中:2Fe2++2I-+2Cl2═2Fe3++4Cl-+I2 |
| B、澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O |
| C、AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
| D、向银氨溶液中加入足量的盐酸:[Ag(NH3)2]++OH-+3H+═Ag++2NH4++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
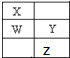 W、X、Y、Z为短周期元素,在周期表中的位置如图所示,有关元素W、X、Y、Z的叙述,不正确的是( )
W、X、Y、Z为短周期元素,在周期表中的位置如图所示,有关元素W、X、Y、Z的叙述,不正确的是( )| A、常压下四种元素的单质中,X的非金属性最强 |
| B、四种元素都能与氧元素形成稳定的化合物 |
| C、Y、Z 离子最外层电子数相同 |
| D、Y元素具有两性元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若甲苯苯环上的一个氢原子被一个含3个碳原子的烷基取代,所得产物有6种 |
B、与 互为同分异构体的芳香族化合物有6种 互为同分异构体的芳香族化合物有6种 |
| C、含有5个碳原子的饱和链烃,其一氯取代物共有8种 |
D、菲的结构简式为 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | A | B | C | D |
| 实验 方案 | 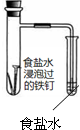 |  |  |  |
| 实验 目的 | 验证铁钉发生了 析氢腐蚀 | 验证Fe电极被保护 | 验证乙烯的产生 | 验证甲烷与氯气发生了化学反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将80 g NaOH 溶于1 L水中,所得溶液中NaOH的物质的量浓度为2 mol?L-1 |
| B、1 L溶液中含2 mol NaOH |
| C、溶液中含2 mol钠离子和2 mol氢氧根离子 |
| D、溶液中钠离子的浓度是2 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① |
| ④ |
| ② |
| ③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com