
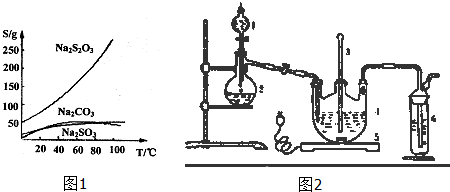
 ��ˮ���Ȼ�����SnCl4����һ����;�㷺���������м��壬��ƷΪ��ɫҺ�壬�۵�-33�棬�е�114.1�棬�ӷ�����ʪ��������ˮ������̣�ijͬѧ����������뾫����Ӧ�Ʊ���ˮ���Ȼ�����ʵ��װ����ͼ�����ּг�װ��δ��������
��ˮ���Ȼ�����SnCl4����һ����;�㷺���������м��壬��ƷΪ��ɫҺ�壬�۵�-33�棬�е�114.1�棬�ӷ�����ʪ��������ˮ������̣�ijͬѧ����������뾫����Ӧ�Ʊ���ˮ���Ȼ�����ʵ��װ����ͼ�����ּг�װ��δ������������ ��1����ˮ���Ȼ�����ʪ��������ˮ������̣�Ũ���������ˮ�Զ����������Ϊ��ֹը�������ܣ���ȴˮ��b������a��������
��2�����ɵ������ܽ������ų�����ֹ����ʵ�飻
��3�����������£�Sn����������������ԭ��Ӧ����SnCl4����ˮ���Ȼ�����ʪ������ˮ������SnO2•XH2O������Ԫ���غ�֪������HCl��
��4���ռ���SnCl4�ӷ�����ʪ��������ˮ������̣������ж�����ֱ���ſգ�����ȡ�������к���HCl��
��5�����Ȼ����������백��ˮ������ϣ�����������������һ�ֹ����ϸС��������Ũ��״������Ԫ���غ㼰��������֪���ÿ���״�������Ȼ�泥����ݷ�Ӧ���������д����ʽ��
��� �⣺��1����ˮ���Ȼ�����ʪ��������ˮ������̣�Ũ���������ˮ�Զ����������Ϊ��ֹ���ɵ�SnCl4ˮ�����Ũ�����������������ƿ�������������¶Ƚϸߣ���������弱����ȴ��ը�������ܣ����ܲ�����ȫ�¹ʣ�Ϊ��ֹը�������ܣ���ȴˮ��b������a��������
�ʴ�Ϊ����ȥ�����е�ˮ������b��
��2���ڼ��������£�Sn�ױ������������Ӷ��������Ȼ����IJ��ʣ�Ϊ��ֹʵ����ţ������ɵ������ܽ������ų����ʴ�Ϊ���ž�װ���п�����
��3�����������£�Sn����������������ԭ��Ӧ����SnCl4����Ӧ����ʽΪSn+2Cl2$\frac{\underline{\;\;��\;\;}}{\;}$SnCl4����ˮ���Ȼ�����ʪ������ˮ������SnO2•XH2O������Ԫ���غ�֪������HCl����Ӧ����ʽΪ SnCl4+��x+2��H2O=SnO2��xH2O+4HCl����
�ʴ�Ϊ��Sn+2Cl2$\frac{\underline{\;\;��\;\;}}{\;}$SnCl4��SnCl4+��x+2��H2O=SnO2��xH2O+4HCl����
��4���ռ���SnCl4�ӷ�����ʪ��������ˮ������̣��ռ�װ����ȱ�ٲ�Ʒ����װ�ã������ж�����ֱ���ſգ�Ӧ����β������װ�ã�Ũ������лӷ����Ҽ��ȴٽ���ӷ���������ȡ�������к���HCl����װ����û�г�ȥ�Ȼ����װ�ã�
�ʴ�Ϊ��ȱ��β������װ�û�װ��E�еIJ�Ʒȱ�ٱ���װ�ã��Ӵ�ʪ����ˮ���δ��ȥ�����е��Ȼ��⣻
��5�����Ȼ����������백��ˮ������ϣ�����������������һ�ֹ����ϸС��������Ũ��״������Ԫ���غ㼰��������֪���ÿ���״�������Ȼ�泥����ݷ�Ӧ���������֪�÷�Ӧ����ʽΪSnCl4+4NH3+4H2O=Sn��OH��4+4NH4Cl���ʴ�Ϊ��SnCl4+4NH3+4H2O=Sn��OH��4+4NH4Cl��
���� ���⿼���Ʊ�ʵ�鷽����ƣ����ؿ���ѧ��ʵ�������������֪ʶ����������Ϊ�߿���Ƶ�㣬��ȷ��ȡ��Ϣ������ʵ��Ŀ�ļ�ʵ������淶���ǽⱾ��ؼ���֪������װ�õ����ü�Ŀ�ģ���Ŀ�Ѷ��еȣ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| T/�� | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �� | B�� | �ڢ� | C�� | �٢ڢ� | D�� | ȫ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com