
| A、+262.6 kJ?mol-1 |
| B、-131.3 kJ?mol-1 |
| C、-352.3 kJ?mol-1 |
| D、+131.3 kJ?mol-1 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
+ 4 |
- 2 |
| A、氯化铵与KNH2反应:NH4Cl+KNH2═KCl+2NH3↑ |
| B、二价活泼金属M与液氨反应:M+2NH3═M(NH2)2+H2↑ |
| C、盐酸与MNH反应:2HCl+MNH═MCl2+NH3↑ |
| D、氯化铵与MO反应:2NH4Cl+MO═M(NH2)2+2HCl+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
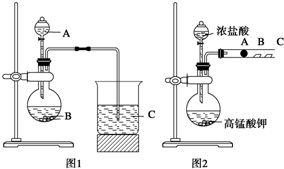 某研究性学习小组设计了一组实验来探究元素周期律.甲同学:根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;
某研究性学习小组设计了一组实验来探究元素周期律.甲同学:根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;查看答案和解析>>
科目:高中化学 来源: 题型:
 氨气的制取及性质探究(图中夹持装置均已略去).
氨气的制取及性质探究(图中夹持装置均已略去).查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.查看答案和解析>>
科目:高中化学 来源: 题型:
| AgCl | AgI | Ag2S | |
| Ksp | 1.8×10-10 | 8.51×10-16 | 6.3×10-50 |
| A、沉淀转化的实质就是沉淀溶解平衡的移动 |
| B、溶解度小的沉淀可以转化为溶解度更小的沉淀 |
| C、AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同 |
| D、25℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com