
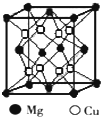
 人类使用铜和它的合金具有悠久的历史,铜及其化合物在电子工业、材料工业、工农业生产及日常生活方面用途非常广泛.试回答下列问题.
人类使用铜和它的合金具有悠久的历史,铜及其化合物在电子工业、材料工业、工农业生产及日常生活方面用途非常广泛.试回答下列问题.| 丁炔铜 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、CH3Br |
| B、CH3CH2CH2CH2Br |
| C、CH2BrCH2CH2CH2Br |
| D、CH3CHBrCH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:
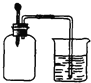 如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内的气体是( )
如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内的气体是( )| A、①② | B、②④ | C、③④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应 后,滴加KSCN溶液 |
溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | Al箔插入稀HNO3中 | 无现象 | Al箔表面被稀HNO3氧化, 形成致密的氧化膜 |
| C | 向某溶液中滴加稀NaOH溶液,将湿润 红色石蕊试纸置于试管口 |
试纸未变蓝 | 不能确定该溶液中是否含 有NH4+ |
| D | 向紫色石蕊试液中通入SO2 | 溶液褪色 | SO2有漂白性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 |
| B、由甘油和浓硝酸制硝化甘油炸药;由甲苯和浓硝酸制TNT炸药 |
| C、由氯代环己烷消去制环己烯;由丙烯加溴制1,2-二溴丙烷 |
| D、由乙醇和浓硫酸共热制乙醚;由乙醇和浓硫酸共热制乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
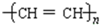 ,这是21世纪具有广阔前景的合成材料.
,这是21世纪具有广阔前景的合成材料.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com