
| A.含金属元素的离子一定是阳离子 |
| B.向新制的FeCl2溶液中滴加NaOH溶液,有红褐色沉淀生成 |
| C.氯水和过氧化钠都具有漂白作用,其漂白原理相似 |
| D.如果将过量的二氧化锰与20mL、12mol?L-1的盐酸混合加热,充分反应生成氯气的物质的量一定为0.06mol |
科目:高中化学 来源:不详 题型:填空题
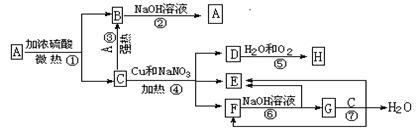
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该反应显示硫酸具有酸性 | B.NH4CuSO3中硫元素被氧化 |
| C.刺激性气味的气体是二氧化硫 | D.反应中硫酸作氧化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| I | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| II | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| III | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| IV | a>x≥c | 无明显变化 | 有Cl2 |
| V | c>x≥b | 无明显变化 | 无Cl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com