
| A. | 天然气 | B. | 生物质能 | C. | 氢能 | D. | 太阳能 |
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
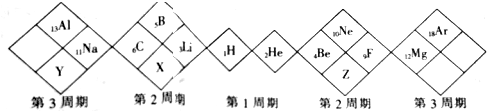
| A. | X元素最高价氧化物对应的水化物为弱酸 | |
| B. | Y元素最外层电子数是最内层电子数的2倍 | |
| C. | 原子半径:Y>X>Z | |
| D. | X、Y、Z的气态氢化物中最稳定的是X的氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1g甲烷和1g氧气的原子数之比为5:1 | |
| B. | 同温同压下甲烷和氧气的密度之比为2:1 | |
| C. | 等物质的量的甲烷和氧气的质量之比为2:1 | |
| D. | 在标准状况下等质量的甲烷和氧气的体积之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2-的结构示意图: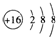 | B. | 中子数为10的氧原子:${\;}_{18}^{8}$O | ||
| C. | HClO的电子式: | D. | 硝基苯的结构简式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置 | 现象 | 结论及解释 |
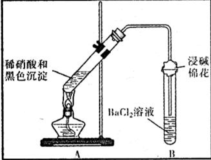 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
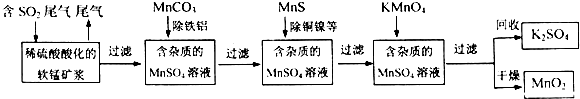
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 能说明H2CO3是弱电解质:HCO3-+H2O?H2CO3+OH- | |
| B. | 能说明溶解性AgCl强于AgI:AgCl+I-═Cl-+AgI | |
| C. | 能说明盐酸是强酸:HCl+AgNO3═AgCl↓+HNO3 | |
| D. | 能说明NH3结合H+能力比H2O强:NH3+H3O+═NH4++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检测时,电解质溶液中的H+向正极移动 | |
| B. | 若有0.4mol电子转移,则在标准状况下消耗2.24L氧气 | |
| C. | 电池反应的化学方程式为:CH3CH2OH+O2═CH3COOH+H2O | |
| D. | 正极上发生的反应为:O2+4e-+2H2O═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH值为1的溶液 Fe3+、NH4+、Cl-、SO42- | |
| B. | 滴加石蕊试液显红色的溶液 Fe2+、Na+、Mg2+、NO3- | |
| C. | 水电离出来的c(H+)=10-13 mol/L的溶液 K+、HCO3-、Br-、Ba2+ | |
| D. | 所含溶质为Na2SO4的溶液 K+、CO32-、NO3-、Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com