
| A. | 气态氢化物的稳定性:W>Z | |
| B. | 简单离子半径:X<Y | |
| C. | 液态ZW4气化需克服分子间作用力 | |
| D. | X、W可以同时出现在同一离子化合物中 |
分析 X、Y、Z、W为原子序数依次增大的短周期非金属元素,且四种元素分别位于四个连续的主族中,Z元素的核电荷数为X元素的2倍,则X为N时,Z为Si,可知Y为O,W为Cl符合题意均为主族非金属元素,以此来解答.
解答 解:由上述分析可知,X为N,Y为O,Z为Si,W为Cl,
A.非金属性W>Z,则气态氢化物的稳定性:W>Z,故A正确;
B.具有相同电子排布的离子中,原子序数大的离子半径小,则简单离子半径:X>Y,故B错误;
C.液态SiCl4为分子晶体,气化需克服分子间作用力,故C正确;
D.X、W可以同时出现在同一离子化合物NH4Cl中,故D正确;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子序数、元素的位置推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | AlCl3 | B. | Al2O3 | C. | Al(OH)3 | D. | Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 “套管实验”是将一个较小的玻璃仪器装入另外一个玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验.因其具有许多优点,近年被广泛开发并应用于化学实验中.下述实验为“套管实验”,请观察如图所示实验装置,分析实验原理,回答下列问题:
“套管实验”是将一个较小的玻璃仪器装入另外一个玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验.因其具有许多优点,近年被广泛开发并应用于化学实验中.下述实验为“套管实验”,请观察如图所示实验装置,分析实验原理,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 关${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se的核外电子数不同 | |
| B. | 关${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se的中子数分别为78和80 | |
| C. | 关${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se的质量数不同,是同种元素 | |
| D. | 关${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se的质子数相同,是同一种核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
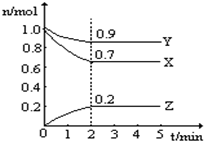 某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:
某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )
如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )| A. | 浓H2SO4 | B. | NaOH溶液 | C. | Na2SO3溶液 | D. | 饱和NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
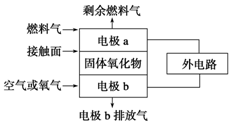 固体氧化物燃料电池的工作原理如图所示,已知电池中电解质为熔融固体氧化物,O2-可以在其中自由移动.当燃料气为C2H4时,其正极、负极反应式分别为
固体氧化物燃料电池的工作原理如图所示,已知电池中电解质为熔融固体氧化物,O2-可以在其中自由移动.当燃料气为C2H4时,其正极、负极反应式分别为查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com