
下列有关氧化还原反应的判断中正确的是( )
|
| A. | 金属单质与盐溶液不一定发生置换反应 |
|
| B. | 侯氏制碱法的原理属于氧化还原反应 |
|
| C. | 阳离子只有氧化性,阴离子只有还原性 |
|
| D. | 失电子的数目越多,说明该物质的还原性越强 |
| 氧化还原反应. | |
| 专题: | 氧化还原反应专题. |
| 分析: | A.金属单质与盐溶液可发生置换、化合等反应; B.侯氏制碱法的原理为二氧化碳通入氨化的饱和氯化钠溶液中反应生成碳酸氢钠晶体析出; C.阳离子可被氧化,阴离子可被还原; D.还原性与失电子多少无关. |
| 解答: | 解:A.金属单质与盐溶液不一定发生置换反应,也可能为化合反应,如Fe+2Fe3+=3Fe2+,故A正确; B.NaCl、氨气、二氧化碳生成纯碱和氯化铵,没有元素的化合价变化,不涉及氧化还原反应,故B错误; C.Fe2+可被氧化,NO3﹣可被还原,具有氧化性,故C错误; D.还原性与失电子的难易有关,与多少无关,故D错误. 故选A. |
| 点评: | 本题考查氧化还原反应,为高频考点,侧重于基本概念的理解,注意把握氧化还原反应的特点以及规律,难度不大. |


科目:高中化学 来源: 题型:
比较等物质的量浓度的:①H2SO3;②NaHSO3;③Na2SO3。三种溶液中[SO32-]的大小,排列正确的是( )
A.①>②>③ B.③>②>①
C.②>①>③ D.③>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:H2(g)+I2(g)2HI(g) ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
( )
A.甲、乙提高相同温度
B.甲中加入0.1 mol He,乙不变
C.甲降低温度,乙不变
D.甲增加0.1 mol H2,乙增加0.1 mol I2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列电离方程式中,正确的是( )
|
| A. | Na2SO4=2Na++SO4﹣2 |
|
| B. | Ba(OH)2⇌Ba2++2OH﹣ |
|
| C. | NaHCO3=Na++H++CO32﹣ |
|
| D. | NH4Fe(SO4)2=NH4++Fe3++2SO42﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下:4NH3+5O2=4NO+6H2O,若有标准状况下VL氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为( )
|
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,其中1mol氧化剂在反应中得到的电子为( )
|
| A. | 10mol | B. | 11mol | C. | 12mol | D. | 13mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
以下是另一种将CO2转化为O2的实验设想
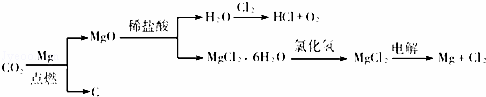
(1)写出Mg在CO2中燃烧的化学方程式 .
(2)MgO溶于稀盐酸后,分离出H2O的操作名称是 .
(3)其中由MgCl2•6H2O制取无水MgCl2的部分装置(铁架台、酒精灯已略)如下: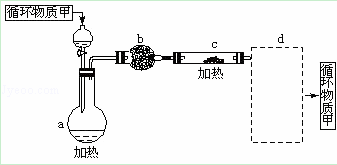
①循环物质甲的名称是 .
②装置b中填充的物质可能是 (填入编号).
a.硅胶 b.碱石灰 c.无水氯化钙 d.浓硫酸.
查看答案和解析>>
科目:高中化学 来源: 题型:
有8种物质:①乙烷;②乙烯;③乙炔;④苯;⑤甲苯;⑥溴乙烷;⑦聚丙烯;⑧环己烯.其中既不能使酸性KMnO4溶液褪色,也不能与溴水反应使溴水褪色的是( )
|
| A. | ①②③⑤ | B. | ④⑥⑦⑧ | C. | ①④⑥⑦ | D. | ②③⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质性质的说法错误的是( )
A.热稳定性:HCl>HI B.原子半径:Na>Mg
C.酸性:H2SO3>H2SO4 D.结合质子能力:S2->Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com