
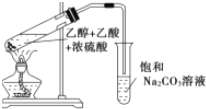
 实验室制备乙酸乙酯,是将3mL乙醇加入一支试管中,然后边振荡试管,边慢慢加入2mL浓H2SO4和2mL乙酸,按如图连接好装置,在酒精灯上加热.观察现象.
实验室制备乙酸乙酯,是将3mL乙醇加入一支试管中,然后边振荡试管,边慢慢加入2mL浓H2SO4和2mL乙酸,按如图连接好装置,在酒精灯上加热.观察现象. )溶于乙醇中并不是简单的物理溶解而是伴随着化学反应,生成了硫酸乙酯(
)溶于乙醇中并不是简单的物理溶解而是伴随着化学反应,生成了硫酸乙酯(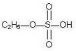 )和硫酸二乙酯(
)和硫酸二乙酯(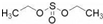 ).
).分析 (1)乙醇与浓硫酸生成酯,即类似于酯化反应,根据酯化反应的断键规律得乙醇与浓硫酸反应生成硫酸乙二酯的化学方程式;(2)根据酯化反应的规律可得硫酸乙酯的结构式,硫酸乙酯与酸反应生成乙酸乙酯,观察硫酸乙酯与乙酸乙酯的结构,满足取代反应的规律,得化学方程式;(3)结合信息,浓硫酸通过改变反应途径参与了该反应;(4)乙酸乙醇极易挥发,产物的减少不利于反应进行,需小火防止其挥发,为了使反应充分进行,大火蒸发出产物有利于平衡正向移动;(5)分离出来的乙酸乙酯中混有少量乙醇和水的混合液,氯化钙可以吸水,除乙醇,再用无水硫酸钠干燥;由题中信息计算,乙醇多,乙酸反应完全,算出理论上.生成乙酸乙酯的质量,再计算产率.
解答 解:(1)题中信息浓硫酸与乙醇生成酯类物质,即类似于酯化反应,根据酯化反应断键规律:酸的羟基与醇羟基上的氢原子结合生成水,得浓硫酸与乙醇生成硫酸乙二酯的化学方程式:2C2H5OH+H2SO4→(OC2H5)2 SO2+2H2O.故答案为:2C2H5OH+H2SO4→(OC2H5)2 SO2+2H2O;(2)由(1)可得浓硫酸与乙醇反应生成产物硫酸乙酯的结构简式为:C2H5OSO2(OH),由题硫酸乙酯与乙酸生成乙酸乙酯,观察可知硫酸乙酯中-SO2(OH)基团被乙酸中的CH3CO-基团取代,根据取代反应的规律,可得硫酸乙酯与乙酸的反应方程式:C2H5OSO2(OH)+CH3COOH→CH3COOC2H5+H2SO4.故答案为:C2H5OSO2(OH)+CH3COOH→CH3COOC2H5+H2SO4 (3)由题中的信息,硫酸在该反应中做催化剂,通过改变反应途径参与了反应,但反应前后浓硫酸并未改变,所以CE正确.故答案为:C E;(4)乙酸乙醇均易挥发,所以为了防止反应物挥发减少,开始小火加热,乙酸与乙醇生成乙酸乙酯的反应是一个可逆反应,为了使反应充分,减少生成物促使反应正向移动,所以大火蒸发出产物乙酸乙酯.故答案为:开始小火加热是为了减少乙酸特别是乙醇的挥发,后来大火加热是为了及时蒸出乙酸乙酯使平衡不断正移;
(5)从饱和碳酸钠溶液中分离出的乙酸乙酯中含有少量乙醇与水的混合液,无水氯化钙吸水,能除掉乙醇;乙酸乙酯在酸性碱性条件下易水解,五氧化二磷与水生成磷酸显酸性,碱石灰中有氢氧化钠,会使乙酸乙酯水解,所以ac错误,选b.由方程式可知,n(乙酸):n(乙醇):n(乙酸乙酯)=1:1:1,由题计算:m(乙酸)=2ml×1.05g/ml=2.1g,则n(乙酸)=2.1g÷60g/mol=0.035mol,m(乙醇)=3ml×0.79g/ml=2.37g,则n(乙醇)=2.37g÷46g/mol=0.05mol,n(乙醇):n(乙酸)=0.05:0.035>1:1,说明乙醇过多,乙酸反应完全,由乙酸计算乙酸乙酯,则理论上生成的乙酸乙酯也为0.035mol,质量为0.035mol×88g/mol=3.08g,实际生成的乙酸乙酯质量为2ml×0.9g/ml=1.8g,故乙酸乙酯的产率为1.8÷3.08×100%≈5≈58.4%.故答案为:乙醇;b;58.4%
点评 本题考查乙酸乙酯等制备,催化剂在反应中的用途,物质的分离提纯,化学原理的运用以及产率的计算,考生需要将已有的一些知识运用到实际情况中,计算不能出错.


科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| B. | 过氧化钠溶于水:2022-+2H2O═4OH-+O2↑ | |
| C. | 将过量二氧化硫气体通入氨水中:SO2+NH3•H2O═HSO3-+NH4+ | |
| D. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 FeCl3•6H2O晶体
FeCl3•6H2O晶体查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe3O4 | Fe2O3 | Fe | |
| 分解温度/°C | 1538 | 1400 | - |
| 熔点/°C | - | - | 1535 |
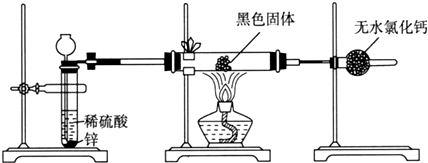
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
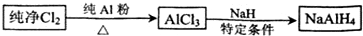
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q2<Q1<92.4 | B. | 2Q2=Q1=92.4 | C. | Q1<Q2<92.4 | D. | Q2=Q1<92.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱用于制造玻璃 | B. | 医药上用小苏打治疗胃酸过多 | ||
| C. | 打磨磁石制指南针 | D. | 工业上利用合成氨实现人工固氮 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com