
硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO.某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验.

已知溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨电离常数Kb=1.8×10﹣5,其饱和溶液中c(OH﹣)约为1×10﹣3mol•L﹣1.请回答:
(1)写出A与氢氧化钠溶液反应的化学方程式: .
(2)上述流程中两次使用试剂①,推测试剂①应该是 A (填以下字母编号)
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(3)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是 ;(任写一点)
(4)固体E为 ,写出溶液F通入过量CO2生成固体G和溶液H的化学方程式: .
(5)计算溶液F中c(Mg2+)= (25℃时,氢氧化镁的Ksp=5.6×10﹣12)
| 常见金属元素的单质及其化合物的综合应用;物质的分离、提纯的基本方法选择与应用.. | |
| 专题: | 几种重要的金属及其化合物. |
| 分析: | 先判断各物质的组成,在根据题目要求分析该题. 硫酸渣的成分为SiO2、Fe2O3、Al2O3、MgO,当向硫酸渣中加过量盐酸时,二氧化硅和盐酸不反应,所以固体A是二氧化硅,氧化铁、氧化铝、氧化镁和盐酸反应,所以溶液B的溶质是氯化镁、氯化铁、氯化铝、盐酸;向溶液B中加试剂①并调节溶液的PH值为3.7,结合题意溶液pH=3.7时Fe3+已经沉淀完全知,试剂①是能和氯化铁反应生成沉淀的物质且和铝离子反应没有沉淀生成,所以试剂①只能是强碱溶液,固体C是氢氧化铁;向溶液D中加入试剂①并调节溶液的PH值为13,溶液呈强碱性溶液,铝元素在溶液中以偏铝酸根离子存在,镁离子和氢氧根离子生成氢氧化镁沉淀,所以固体E是氢氧化镁;溶液F的溶质含有偏铝酸钠和氯化钠,向F溶液中通入过量二氧化碳气体,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀,所以G是氢氧化铝. (1)根据二氧化硅和氢氧化钠的性质写出相应的化学反应方程式. (2)能使铁离子产生沉淀,而铝离子不产生沉淀的物质只能是强碱. (3)在强碱性条件下,铝元素以偏铝酸根离子存在,镁元素以氢氧化镁存在,据此分析. (4)氢氧化铝的酸性比碳酸还弱,根据强酸制取弱酸知,偏铝酸钠和过量二氧化碳能反应生成氢氧化铝和碳酸氢钠. (5)根据c(Mg2+)= |
| 解答: | 解:硫酸渣的成分为SiO2、Fe2O3、Al2O3、MgO,当向硫酸渣中加过量盐酸时,二氧化硅和盐酸不反应,所以固体A是二氧化硅,氧化铁、氧化铝、氧化镁和盐酸反应,所以溶液B的溶质是氯化镁、氯化铁、氯化铝、盐酸;向溶液B中加试剂①并调节溶液的PH值为3.7,结合题意溶液pH=3.7时Fe3+已经沉淀完全知,试剂①是能和氯化铁反应生成沉淀的物质且和铝离子反应没有沉淀生成,所以试剂①只能是强碱溶液,固体C是氢氧化铁;向溶液D中加入试剂①并调节溶液的PH值为13,溶液呈强碱性溶液,铝元素在溶液中以偏铝酸根离子存在,镁离子和氢氧根离子生成氢氧化镁沉淀,所以固体E是氢氧化镁;溶液F的溶质含有偏铝酸钠和氯化钠,向F溶液中通入过量二氧化碳气体,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀,所以G是氢氧化铝. (1)通过以上分析知,A是二氧化硅,二氧化硅是酸性氧化物,能和强碱反应生成盐和水, 所以反应方程式为:SiO2+2NaOH=Na2SiO3+H2O. 故答案为:SiO2+2NaOH=Na2SiO3+H2O. (2)向溶液B中加试剂①并调节溶液的PH值为3.7,结合题意知,溶液pH=3.7时Fe3+已经沉淀完全知,试剂①是能和氯化铁反应生成沉淀的物质且和铝离子反应没有沉淀生成,所以试剂①只能是强碱溶液,符合条件的是A选项. 故选A. (3)在强碱性条件下,铝元素以偏铝酸根离子存在,镁元素以氢氧化镁存在,当溶液的PH=13时,溶液呈强碱性,如果pH过小,可能导致的后果是镁离子沉淀不完全或氢氧化铝溶解不完全等. 故答案为:镁离子沉淀不完全或氢氧化铝溶解不完全等. (4)通过以上分析知,固体E为Mg(OH)2,氢氧化铝的酸性比碳酸还弱,根据强酸制取弱酸知,偏铝酸钠和过量二氧化碳能反应生成氢氧化铝和碳酸氢钠,反应方程式为 NaAlO2+CO2+H2O=Al(OH)3↓+NaHCO3. 故答案为:Mg(OH)2;NaAlO2+CO2+H2O=Al(OH)3↓+NaHCO3. (5)c(Mg2+)= 故答案为:5.6×10﹣10 mol/L. |
| 点评: | 本题考查了物质的分离、提纯的方法选择及应用,难度不大,明确各物质的性质是解本题的关键. |


科目:高中化学 来源: 题型:
下列各组中的性质比较,不正确的是( )
A.稳定性:NH3<PH3<SiH4
B.酸性:HClO4>H2SO4>H3PO4
C.碱性:KOH>NaOH>Mg(OH)2
D.还原性:F-<Cl-<Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为
P4(s,白磷)+5O2(g)===P4O10(s) ΔH1=-2 983.2 kJ·mol-1
P(s,红磷)+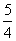 O2(g)===
O2(g)===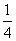 P4O10(s) ΔH2=-738.5 kJ·mol-1
P4O10(s) ΔH2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为__ ______________。
______________。
(2)已知298 K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)===P4O6(s)
ΔH=-1 638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为________, 反应过程中放出的热量为________。
反应过程中放出的热量为________。
(3)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P 198,Cl—Cl 243,P—Cl 331。
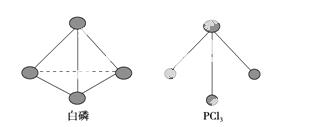
则反应P4(s,白磷)+6Cl2(g)===4PCl3(s)的反应热ΔH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
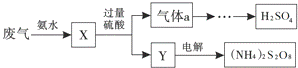
某硫酸厂废气中SO2的回收利用方案如图所示.下列说法不正确的是( )
|
| A. | X可能含有2种盐 | B. | a是SO3 |
|
| C. | Y可能含有(NH4)2SO4 | D. | (NH4)2S2O8中S的化合价不可能为+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
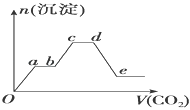
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示.下列关于整个反应过程中的叙述不正确的是( )
|
| A. | Oa段反应的化学方程式是Ba(OH)2+CO2═BaCO3↓+H2O |
|
| B. | ab段与cd段所发生的反应相同 |
|
| C. | de段沉淀减少是由于BaCO3固体消失的 |
|
| D. | bc段反应的离子方程式是2AlO2﹣+3H2O+CO2═2Al(OH)3↓+CO32﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与环境、材料、信息、能源关系密切,下列说法正确的是
A.绿色化学的核心是应用化学原理对环境污染进行治理
B.开发高效氢能、太阳能等新型电动汽车,以解决城市机动车尾气排放问题
C.PM 2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体
D.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
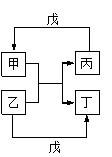
甲、乙、丙、丁、戊的相互转化关系如图所示(部分反应物及反应条件已略去,箭头表示一步转化)。下列各组物质中,满足图示转化关系的是
| 物质 选项 | 甲 | 乙 | 丙 | 戊 | 丁 |
| A | Cu | HNO3 | Cu(NO3)2 | Fe | NO |
| B | H2O | Fe | H2 | O2 | Fe2O3 |
| C | Al | NaOH | H2 | Al2O3 | NaAlO2 |
| D | CH3CHO | O2 | CH3COOH | H2 | H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨反应:3H2+N2 2NH3其反应速率可以分别用v(H2)、v(N2)、v(NH3)[单位均为mol/(L·s)]表示,则正确的关系是
 ( )
( )
A.v(H2)=v(N2)=v(NH3)
B.v(N2)=2v(NH3)
C.v(H2)=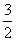 v(NH3)
v(NH3)
D.v(N2)=3v(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
用坩埚钳夹住一小块刚用酸处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落。下列关于实验现象的解释不正确的是( )
A.铝在空气中能很快形成氧化膜 B.氧化铝薄膜兜住了熔化的铝
C.氧化铝的熔点比铝高 D.铝箔表面温度低,未熔化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com