
在一密闭容器中充入1molH2和1molI2,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)=2HI(g)△H<0.
(1)保持容器容积不变,向其中加入1molH2,反应速率加快吗?说明理由.
(2)保持容器容积不变,向其中加入1molN2(N2不参加反应),反应速率也加快吗?说明理由.
(3)保持容器内气体压强不变,向其中加入1molN2(N2不参加反应),反应速率 ,理由是 .
(4)保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),反应速率 ,理由是 .
(5)提高反应的起始温度,反应速率 ,理由是 .
考点:
化学反应速率的影响因素.
专题:
化学反应速率专题.
分析:
体积不变时,通入参加反应的气体,反应物或生成物浓度增大,反应速率增大;如通入惰性气体或不参加反应的气体,如参加反应的气体的浓度不变,则反应速率不变;
压强不变,如等配比数通入气体,则反应速率不变,如通入惰性气体或不参加反应的气体,参加反应的物质的浓度降低,反应速率减小;
升高温度,反应速率增大.
解答:
解:(1)保持容器容积不变,向其中加入1molH2,氢气的浓度增大,单位体积的活化分子数目增大,则反应速率增大,
答:反应速率加快,反应物浓度增大,反应速率增大;
(2)保持容器容积不变,向其中加入1molN2(N2不参加反应),由于参加反应气体的浓度不变,则反应速率不变,
答:反应速率不加快,原因是参加反应气体的浓度不变;
(3)保持容器内气体压强不变,向其中加入1molN2(N2不参加反应),则体积应增大,气体浓度减小,则反应速率减小,
故答案为:减小;参加反应的气体的浓度减小;
(4)保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),则物质的量增大一倍,体积也应增大一倍,反应物的浓度不变,则反应速率不变,
故答案为:不变;浓度不变;
(5)提高反应的起始温度,增加活化分子百分数,则反应速率增大,
故答案为:增大;活化分子百分数增大,有效碰撞次数增多.
点评:
本题综合考查反应速率的影响因素,注意浓度、温度以及压强对反应速率的影响,难度不大,注意相关基础知识的积累.


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
参照反应Br+H2→HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )
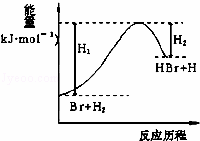
A. 正反应为放热反应
B. 断键吸收的总能量大于成键放出的总能量
C. 反应物总能量高于生成物总能量
D. 升高温度可增大正反应速率,降低逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶气体是( )
①CO、O2 ②Cl2、CH4 ③NO2、O2 ④N2、H2.
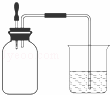
A. ①② B. ②④ C. ③④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,下列可逆反应达到化学平衡:I2(g)+H2(g)⇌2HI(g);△H<0,要使混合气体的颜色加深,可以采取的方法是( )
|
| A. | 降低温度 | B. | 增大H2的浓度 | C. | 增大压强 | D. | 减小压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应2NO(g)⇌O2(g)+N2(g);△H=﹣180kJ.mol﹣1,对此反应的逆反应,下列说法正确的是( )
|
| A. | 升高温度平衡常数K增大 |
|
| B. | 升高温度平衡常数K减小 |
|
| C. | 增大压力则平衡移动 |
|
| D. | 增大N2浓度,则NO分解率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A.1 mol H2O的质量为18g
B.摩尔是表示物质微粒数目的一个物理量
C.3.01×1023个SO2分子的质量为64g
D.标准状况下,1 mol任何物质体积均约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
对于X+YZ的平衡,若增大压强,Y的转化率增大,则X和Z可能的状态是( )
A.X为液态,Z为气态
B.X为固态,Z为气态
C.X为气态,Z为气态
D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
有德国重离子研究中心人工合成的第112号元素的正式名称为“Copernicium”,相应的元素符号位“Cn”.该元素的名称是为了纪念天文学家哥白尼而得名.该中心人工合成Cn的过程可表示为: Zn+
Zn+ ═
═
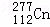 +
+ 下列叙述中正确的是( )
下列叙述中正确的是( )
A. 上述合成过程中属于化学变化
B. Cn元素的相对原子质量为277
C.  Cn的原子核内中子数比质子数多53
Cn的原子核内中子数比质子数多53
D. Cn元素位于元素周期表的第六周期,是副族元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com