
一定温度下,向容积恒定的密闭容器中投入2 mol A和1 mol B,发生如下可逆反应:2A(g)+B(g)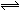 C(g)+D(s)。达到平衡时,测得压强为原压强的5/6。则A的转化率为( )
C(g)+D(s)。达到平衡时,测得压强为原压强的5/6。则A的转化率为( )
A.25% B.40% C.50% D.75%
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 5 |
| 7 |
| 5 |
| 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).| c(CH3OH) |
| c(CO)?c2(H2) |
| c(CH3OH) |
| c(CO)?c2(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
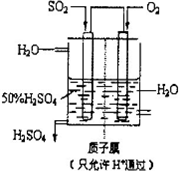 (2010?聊城模拟)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
(2010?聊城模拟)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.| 1 |
| 2 |
| 10 |
| 3 |
c(C
| ||
c(S
|
查看答案和解析>>
科目:高中化学 来源: 题型:
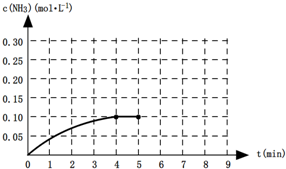
查看答案和解析>>
科目:高中化学 来源:2014届四川省绵阳市高三第一次诊断性考试理综化学试卷(解析版) 题型:选择题
一定条件下,通过下列反应可实现燃煤烟气中的硫的回收:SO2(g)+2CO(g) 2CO2(g)+S(l) △H<0。一定温度下,在容积为2L的恒容密闭容器中1molSO2和nmolCO发生反应,5min后达到平衡,生成2amolCO2。下列说法正确的是
2CO2(g)+S(l) △H<0。一定温度下,在容积为2L的恒容密闭容器中1molSO2和nmolCO发生反应,5min后达到平衡,生成2amolCO2。下列说法正确的是
A.反应前2min的平均速率v(SO2)=0.1amol/(L.min)
B.当混合气体的物质的量不再改变时,反应达到平衡状态
C.平衡后保持其它条件不变,从容器中分离出部分硫,平衡向正反应方向移动
D.平衡后保持其他条件不变,升高温度和加入催化剂,SO2的转化率均增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com