


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
| A、三种元素都是非金属元素 |
| B、由三种元素形成的物质既含离子键又含共价键 |
| C、三种化合物都是共价化合物 |
| D、各1mol的M、N与水反应所得气体体积比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32- |
| B、肯定存在的离子是Na+、K+、CO32-、Br- |
| C、无法确定原溶液中是否存在Cl- |
| D、若步骤④改用BaCl2溶液和盐酸的混合溶液,则对溶液中离子的判断无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
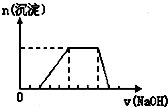 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2分子的结构较稳定,因而氮气不能支持任何物质燃烧 |
| B、23gNO2和N2O4混合气含有0.5NA个氮原子(NA表示阿伏加德罗常数) |
| C、检验NH4+存在时,用湿润的蓝色石蕊试纸 |
| D、浓硝酸保存在棕色瓶内是因为硝酸易挥发 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2能使FeCl3、KMnO4溶液褪色 |
| B、用澄清石灰水可鉴别CO2和SO2 |
| C、S在O2中燃烧可生成SO3 |
| D、SO2通人BaCl2溶液中能产生白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com