
| A��0.1 mol?L-1 pHΪ4��NaHB��Һ�У�c��HB-����c��H2B����c��B2-�� |
| B�������ʵ���Ũ�ȵ�������Һ�У���NH4Al��SO4��2����NH4Cl����CH3COONH4����NH3?H2O��c��NH4+���ɴ�С��˳���ǣ��٣��ڣ��ۣ��� |
| C��a mol?L-1 HCN��Һ�� a mol?L-1 NaOH��Һ�������Ϻ�������Һ��c��Na+����c��CN-������c��OH-����c��H+�� |
| D��0.1 mol?L-1 HCOOH��Һ�У�c��HCOO-��+c��OH-��=c��H+�� |


 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| X | Y | ||
| Z | W |
| A��ԭ�Ӱ뾶Z��W��Y |
| B������������Ӧˮ���������Z��W |
| C���⻯����ȶ���X��Z |
| D��X���⻯����Y���⻯���ܷ������Ϸ�Ӧ�������ӻ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
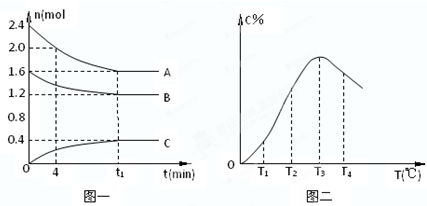
| A��0��4����ʱ��A������Ϊ0.01mol/��L?min�� | ||
| B����T1��T2�仯ʱ��V����V | ||
C���÷�Ӧ��ƽ�ⳣ������ʽK=
| ||
| D���˷�Ӧ������ӦΪ���ȷ�Ӧ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Na2O2��Na2O�� |
| B��KCl��KClO3�� |
| C��Na2CO3��NaHCO3�� |
| D��NH4Cl��I2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ȩ | B���Ҵ� |
| C����ϩ | D���ѻ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ����� | |
| �� | KCl��K2SO4��Na2CO3��NaCl |
| �� | KCl��BaCl2��Na2SO4��K2CO3 |
| �� | Na2SO4��KCl��K2CO3��NaCl |
| �� | KCl��CuSO4��Na2CO3��NaCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��1L����Һ�к������ 202 g |
| B��100mL����Һ�к������ 0.02 mol |
| C����1L����Һ��ȡ�� 500 mL ��ʣ����Һ��Ũ��Ϊ 0.1mol/L |
| D��1Lˮ���ܽ� 0.2 mol ����أ��������0.2 mol/L�������Һ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com