
| A. | 20% | B. | 12.5% | C. | 17.5% | D. | 25% |
分析 Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应:2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应:2H2O+2Na2O2=4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知反应后固体增加的质量为氢气质量,相当于是H2、CO与过氧化钠直接发生化合反应,恢复到原温度,容器内的压强为原来的$\frac{1}{4}$,剩余气体只能为O2,不可能为H2或CO,设反应后生成氧气的物质的量为n,则反应前气体总物质的量为4n,根据反应2CO2+2Na2O2=2Na2CO3+O2可知二氧化碳的物质的量为2n,再设出CO、氢气的物质的量,然后结合平均式量列式计算.
解答 解:Na2O2与CO2反应方程式为:2CO2+2Na2O2=2Na2CO3+O2,
CO与H2在氧气中完全燃烧生成CO2和H2O,生成的CO2和H2O再与Na2O2反应:2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量,说明CO完全转化成固体;
氢气燃烧反应为:2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应:2H2O+2Na2O2=4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知反应后固体增加的质量为氢气质量,氢气在反应后完全转化成固体;
混合气体中的H2、CO与过氧化钠直接发生化合反应转化成固体,恢复到原温度容器内的压强为原来的$\frac{1}{4}$,则剩余气体只能为O2,设反应后生成氧气的物质的量为n,
则反应前气体总物质的量为4n,根据反应2CO2+2Na2O2=2Na2CO3+O2可知二氧化碳的物质的量为2n,
设原混合气体中H2、CO的物质的量分别为x、y,原混合气体中CO2、CO、H2三种气体的平均式量为26.25,则①$\frac{44×2n+2x+28y}{2n+x+y}$=26.25,CO和氢气的总物质的量为:②x+y=4n-2n=2n,联立①②解得:$\left\{\begin{array}{l}{x=1.5n}\\{y=0.5n}\end{array}\right.$,
所以原混合气体中CO的体积分数为:$\frac{0.5n}{4n}$×100%=12.5%,
故选B.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握平均式量的含义及计算方法,试题培养了学生的分析能力及化学计算能力.


 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:选择题
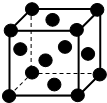 经探明我国在沿海大陆架和西藏地区蕴含丰富的可燃冰即甲烷水合物,如图是一种甲烷晶体的结构,图中每个小球代表一个甲烷分子(甲烷分子分别位于立方体的顶点和面心),下列有关该晶体说法正确的是( )
经探明我国在沿海大陆架和西藏地区蕴含丰富的可燃冰即甲烷水合物,如图是一种甲烷晶体的结构,图中每个小球代表一个甲烷分子(甲烷分子分别位于立方体的顶点和面心),下列有关该晶体说法正确的是( )| A. | 该晶体与氯化钠的晶体类型相同 | |
| B. | 该晶体熔化只需要破坏共价键 | |
| C. | SiH4分子的稳定性强于甲烷 | |
| D. | 每个顶点的甲烷与之距离最近的甲烷分子有12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入足量的溴水 | B. | 通入足量的酸性高锰酸钾溶液 | ||
| C. | 在导管口点燃 | D. | 一定条件下与H2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.1mol•L-1的氨水含有0.1NA个OH- | |
| B. | 常温常压下,22.4 LCCl4含有NA个CCl4分子 | |
| C. | 1mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 | |
| D. | 常温下,23g N2O4和NO2的混合气体中,含有NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氯气和氢氧化钠溶液制消毒水 | B. | 用铝热法冶炼金属钒 | ||
| C. | 用油脂制肥皂 | D. | 海水提溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①②④ | C. | ①②③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CO2 和CO与我们的社会生活联系相当密切,某化学课题组对此进行了探究.
CO2 和CO与我们的社会生活联系相当密切,某化学课题组对此进行了探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 分离方法 | 原理 |
| A | 使用CCl4提取碘水中的碘 | 萃取、分液 | 碘在CCl4中的溶解度较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 除去淀粉胶体中的NaCl | 过滤 | 淀粉胶体不能透过滤纸 |
| D | 分离氯化钠和氯化铵 | 升华 | 氯化铵易升华 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com