
分析 前四周期元素A、B、C、D、E、F,原子序数依次递增.E的未成对电子数是前四周期中最多的,外围电子排布式为3d54s1,则E为Cr;F的最外层电子数为2,内层全部排满,原子序数大于Cr,处于第四周期,与核外电子数为2+8+18+2=30,故F为Zn;E外围电子数与D相同,则D处于VIA族,A、B、D、C的价电子数依次增多,则C处于ⅦA族,且C元素的原子半径最小,而C的原子序数小于D,可推知C为F元素、D为S元素;A有两个单电子,原子序数小于氟,核外电子排布为1s22s22p2或1s22s22p4,由原子序数可知A与氟不相邻,故A为C元素,则B为N元素.
解答 解:前四周期元素A、B、C、D、E、F,原子序数依次递增.E的未成对电子数是前四周期中最多的,外围电子排布式为3d54s1,则E为Cr;F的最外层电子数为2,内层全部排满,原子序数大于Cr,处于第四周期,与核外电子数为2+8+18+2=30,故F为Zn;E外围电子数与D相同,则D处于VIA族,A、B、D、C的价电子数依次增多,则C处于ⅦA族,且C元素的原子半径最小,而C的原子序数小于D,可推知C为F元素、D为S元素;A有两个单电子,原子序数小于氟,核外电子排布为1s22s22p2或1s22s22p4,由原子序数可知A与氟不相邻,故A为C元素,则B为N元素.
(1)E的未成对电子数是前四周期中最多的,价电子排布式为3d54s1,
故答案为:3d54s1;
(2)在碳形成的化合物中,碳原子采取sp2杂化,且分子量最小的化合物为为C2H4,键角约为120°,
故答案为:C2H4;120°;
(3)A.冰中每个水分子与周围4个水分子形成氢键,形成空隙的笼状结构,容纳甲烷分子,可燃冰的形成与氢键有关,故A正确;
B.碳的电负性较小,其氢化物中不能形成氢键,氢化物沸点与氢键无关,故B错误;
C.氮元素的氢化物的热稳定性与元素非金属性有关,与氢键无关,故C错误,
故选:A;
(4)Cr3+可以与CN-形成配离子,其中Cr3+以d2sp3方式杂化,杂化轨道全部用来与CN-形成配位键,即形成6个配位键,则Cr3+的配位数为6,形成配离子为[Cr(CN)6]3-,配位键属于σ 键,CN-中含有1个σ 键,故1mol该配离子中含有12molσ 键,
故答案为:6;12;
(5)在F和S形成的化合物中,中心原子没有孤电子对的分子为SF6,价层电子对数为6,空间构型为 正八面体,
故答案为:正八面体;
(6)同周期过渡金属从左到右原子半径变化缓慢,原子核对外层电子的吸引力变化不大,所以第一电离能没有主族元素变化明显,
故答案为:同周期过渡金属从左到右原子半径变化缓慢,原子核对外层电子的吸引力变化不大,所以第一电离能没有主族元素变化明显;
(7)F为Zn,D为S,二者形成化合物为ZnS,Zn、S的配位数相等,图中黑色球配位数为4,故Zn的配位数为4,晶胞中黑色球数目为4,则晶胞中Zn、S原子数目均为4,晶胞质量为4×$\frac{65+32}{{N}_{A}}$g,晶体密度为ag/cm3,则晶胞边长为$\root{3}{\frac{4×\frac{65+32}{{N}_{A}}g}{ag/c{m}^{3}}}$=$\root{3}{\frac{388}{a•{N}_{A}}}$cm,即晶胞边长为$\root{3}{\frac{388}{a•{N}_{A}}}$×1010pm,
故答案为:4;$\root{3}{\frac{388}{a•{N}_{A}}}$×1010.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、分子结构、氢键、配合物、晶胞计算等,推断元素是解题关键,需要学生具备扎实的基础与灵活运用的能力.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 焊锡中加铅后熔点降低 | |
| B. | 用漂白粉、臭氧等游泳池消毒 | |
| C. | 将镁块与钢铁输水管相连,防止钢铁腐蚀 | |
| D. | 往燃煤中加入石灰石,减少酸雨的产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
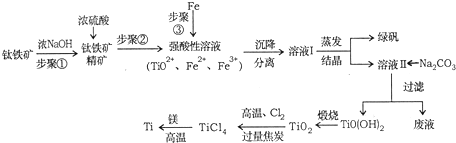
| PH | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | TiO(OH)2 |
| 开始沉淀 | 1.1 | 4.5 | 7 | 1 |
| 完全沉淀 | 2.8 | 6.4 | 9.2 | 2.7 |
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
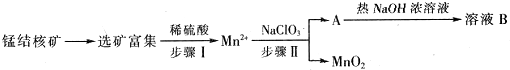
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
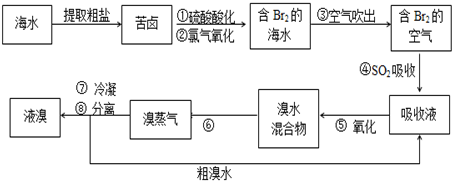
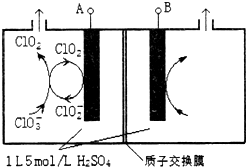 二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
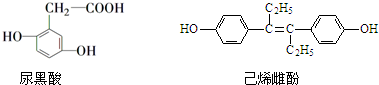
| A. | 尿黑酸分子中所有碳原子一定都在同一平面内 | |
| B. | 己烯雌酚可发生加成、取代、氧化、加聚、酯化反应 | |
| C. | 尿黑酸和己烯雌酚都属于芳香族化合物 | |
| D. | 各1mol的尿黑酸和己烯雌酚分别最多能消耗3mol 和6mol Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
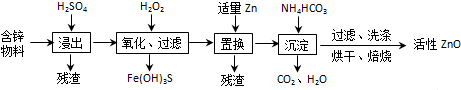
| A. | 上述流程中,浸出时用的是60% H2SO4(密度是1.5g/cm3),如配制100 mL这种H2SO4溶液,则需要18.4mol•L-1的浓硫酸约为49.9mL | |
| B. | 若生成的沉淀是形态均为Zna(OH)b (CO3)c的(a、b、c都是正整数)两种碱式碳酸锌的混合物,则分别可能是Zn5(OH)6(CO3)2 与Zn3(OH)6CO3 | |
| C. | 若加入NH4HCO3后生成的沉淀是Zn5(OH)6(CO3)2,则该反应为5ZnSO4+10NH4HCO3═Zn5(OH)6(CO3)2↓+5(NH4)2SO4+8CO2↑+2H2O | |
| D. | 加入氧化剂H2O2后,只有Fe(OH)3沉淀出现,若溶液中c(Fe3+)═2.6×10-15mol•L-1,则溶液中c(Cu2+)≤2.2×10-4mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com