
【题目】目前“低碳经济”正成为科学家研究的主要课题。请回答下列问题:
Ⅰ.甲烷自热重整是一种先进的制氢方法,其反应方程式为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。
CO(g)+3H2(g)。
(1)阅读下图,计算上述反应的反应热ΔH=________kJ·mol-1。

Ⅱ.用CH4或其他有机物、O2为原料可设计成燃料电池。
(2)以CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池,则负极的电极反应式为________________________________________________________________________。
(3)以CH4、O2为原料,100mL0.15mol·L-1NaOH溶液为电解质设计成燃料电池,若放电时参与反应的氧气体积为448mL(标准状况),产生的气体全部被溶液吸收,则所得溶液中溶质的成分及物质的量之比为________________________,各离子浓度由大到小的顺序为________________________________________________________________________。
Ⅲ.利用I2O5消除CO污染的反应为5CO(g)+I2O5(s)![]() 5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4molCO,测得CO2的体积分数随时间t变化曲线如下图。请回答:
5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4molCO,测得CO2的体积分数随时间t变化曲线如下图。请回答:
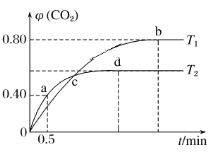
(4)T2时,0~0.5min内的反应速率v(CO)=________________。
(5)T1时化学平衡常数K=________。
(6)下列说法不正确的是________(填标号)。
A.容器内气体密度不变,表明反应达到平衡状态
B.两种温度下,c点时体系中混合气体的压强相等
C.d点时,增大体系压强,CO的转化率不变
D.b点和d点时化学平衡常数的大小关系:Kb<Kd
【答案】+161.1CnH2nOn-4ne-+nH2O===nCO2+4nH+n(Na2CO3)∶n(NaHCO3)=1∶1c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)1.6mol·L-1·min-11024BD
【解析】
Ⅰ.(1)由能量图,得①CH4(g)+2O2(g)→CO2(g)+2H2O(g)△H=-846.3kJmoL-1,②CO2(g)═CO(g)+![]() O2(g)△H=+282kJmoL-1,③
O2(g)△H=+282kJmoL-1,③![]() O2(g)+H2(g)═H2O(g)△H=-241.8kJmoL-1,根据盖斯定律,将①-③×3+②得CH4(g)+H2O(g)
O2(g)+H2(g)═H2O(g)△H=-241.8kJmoL-1,根据盖斯定律,将①-③×3+②得CH4(g)+H2O(g)![]() CO(g)+3H2(g)△H=(-846.3+241.8×3+282)kJmoL-1=+161.1kJmoL-1;故答案为:+161.1;
CO(g)+3H2(g)△H=(-846.3+241.8×3+282)kJmoL-1=+161.1kJmoL-1;故答案为:+161.1;
(2)燃料电池中,负极上投放燃料所以投放甲烷的电极是负极,负极上失电子发生氧化反应,电极反应式为:CnH2nOn-4ne-+nH2O═nCO2+4nH+,故答案为:CnH2nOn-4ne-+nH2O═nCO2+4nH+;
(3)参与反应的氧气在标准状况下体积为448mL,物质的量为![]() =0.02mol,假设生成二氧化碳,根据电子转移守恒可知,生成二氧化碳为
=0.02mol,假设生成二氧化碳,根据电子转移守恒可知,生成二氧化碳为![]() =0.01mol,n(NaOH)=0.1L×0.15molL-1=0.015mol,n(NaOH):n(CO2)=0.015mol:0.01mol=3:2,实质上发生反应2CO2+3NaOH=Na2CO3+NaHCO3+H2O,所以所得溶液中溶质的成分及物质的量之比为n(Na2CO3):n(NaHCO3)=1:1;溶液中碳酸根水解,碳酸氢根的水解大于电离,溶液呈碱性,故c(OH-)>c(H+),碳酸根的水解程度大于碳酸氢根,故c(HCO3-)>c(CO32-),钠离子浓度最大,水解程度不大,碳酸根浓度原大于氢氧根离子,故c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故答案为:n(Na2CO3):n(NaHCO3)=1:1;c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
=0.01mol,n(NaOH)=0.1L×0.15molL-1=0.015mol,n(NaOH):n(CO2)=0.015mol:0.01mol=3:2,实质上发生反应2CO2+3NaOH=Na2CO3+NaHCO3+H2O,所以所得溶液中溶质的成分及物质的量之比为n(Na2CO3):n(NaHCO3)=1:1;溶液中碳酸根水解,碳酸氢根的水解大于电离,溶液呈碱性,故c(OH-)>c(H+),碳酸根的水解程度大于碳酸氢根,故c(HCO3-)>c(CO32-),钠离子浓度最大,水解程度不大,碳酸根浓度原大于氢氧根离子,故c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故答案为:n(Na2CO3):n(NaHCO3)=1:1;c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
Ⅱ.(4)a点时:5CO(g)+I2O5(s)5CO2(g)+I2(s)
起始量/mol 4 0
转化量/mol x x
a点量/mol 4-x x
根据a点时CO2的体积分数φ(CO2)=![]() =0.40,得x=1.6mol,
=0.40,得x=1.6mol,
则从反应开始至a点时的反应速率为v(CO)=![]() =1.6molL-1min-1,故答案为:1.6molL-1min-1;
=1.6molL-1min-1,故答案为:1.6molL-1min-1;
(5)T1时:5CO(g)+I2O5(s)5CO2(g)+I2(s)
起始量/mol
转化量/moly y
b点量/mol4-y y
根据b点时CO2的体积分数φ(CO2)=![]() =0.80,得y=3.2mol,c(CO)=0.4molL-1,c(CO2)=1.6molL-1,T1时化学平衡常数K=
=0.80,得y=3.2mol,c(CO)=0.4molL-1,c(CO2)=1.6molL-1,T1时化学平衡常数K=![]() =
=![]() =1024,故答案为:1024;
=1024,故答案为:1024;
(6)A.因为条件为恒容,而反应前后气体质量变化,所以容器内气体密度不变时,表明反应达到平衡状态,故A正确;B.c点为交点,气体物质的量分别相等,所以两种温度下,体系中混合气体的压强不等,故B错误;C.反应前后气体体积不变,压强变化对平衡无影响,CO的转化率不变,故C正确;D.b点比d点时生成物CO2体积分数大,说明进行的程度大,则化学平衡常数:Kb>Kd,故D错误;故答案为:BD。


科目:高中化学 来源: 题型:
【题目】铁及其化合物在日常生产生活中应用广泛,研究铁及其化合物的应用意义重大。
(1)所含铁元素只有还原性的物质是_________。
A.Fe B.FeCl2 C.FeCl3 D.Fe2O3
(2)当人体缺铁时,往往需要吃补铁保健品。人体能够吸收的是+2价的铁,但是+2价的铁很容易被氧化。
①如何检验某固体补铁剂中铁元素已被氧化?写出操作过程、现象及结论。
答:____________________________________________________________________。
②服用维生素C,可使食物中的三价铁离子转化为二价铁离子。由此可推知,维生素C具有________________(填化学性质)。
(3) 高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、C1O-、OH-、FeO42-、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:_____Fe(OH)3+_____ClO-+_________=_____FeO42-+_____Cl-+_________
(4)工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:
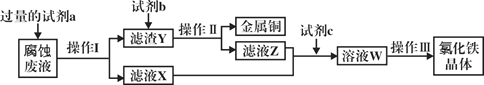
回答下列问题:
①试剂a是___________,操作I用到的玻璃仪器有烧杯、玻璃棒和___________。
②滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为___________。
③上述流程中操作III包括________________、________________、过滤、洗涤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列共价键①H-H、②H-F、③H-O、④N-H 中,键的极性由小到大的顺序正确的是
A. ①②③④B. ④③②①C. ①④③②D. ②③④①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的H2SO4溶液中,分别滴入物质的量浓度相等的Ba(OH)2、NaOH溶液,其导电能力随滴入溶液体积变化的曲线如下图所示,下列分析不正确的是

A. ①代表滴加Ba(OH)2溶液的变化曲线 B. a、c两点,溶液中均大量存在H+和SO42-
C. b、d两点对应的溶液均显中性 D. e点,两溶液中含有相同量的OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于浓硫酸的叙述正确的是 ( )
A. 浓硫酸具有脱水性,因而能使蔗糖炭化
B. 浓硫酸具有强酸性,因而能用来制备硝酸和盐酸
C. 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D. 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用如图装置制取溴本先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
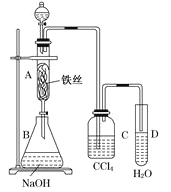
(1)A中铁丝发生如下反应2Fe+3Br2=2FeBr3,FeBr3的作用是_______,请写出A中另外个反应的化学方程式:__________
(2)观察到A中的气体颜色是由_____色变成________色。
(3)实验结束时,打开A下端的活寒,让反应液流入B中,充分振荡,目的是________
(4)C中盛放CCl4的作用是__________
(5)能证明苯和液溴发生的是取代反应,而不是加成反应的方法是验证是否有HBr的生成,故而可向试管D中滴入石蕊溶液,若溶液变红,则能证明。另一种验证的方法是向试管D中加入___________,现象是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A | B | C | D | |
实验 | NaOH溶液滴入FeSO4溶液中 | 石蕊溶液滴入氯水中 | Na2S溶液滴入AgCl浊液中 | 热铜丝插入稀硝酸中 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变红,随后迅速褪色 | 沉淀由白色逐渐变为黑色 | 产生无色气体,随后变为红棕色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去混入CO2中的SO2和O2,下列试剂的使用顺序正确的是( )
①饱和Na2CO3溶液 ②饱和NaHCO3溶液
③浓H2SO4溶液 ④灼热的铜网 ⑤碱石灰
A.①③④B.②③④
C.②④⑤D.③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com