
| A. | 在10g质量分数为46%的乙醇水溶液中含有H原子数目为1.2NA | |
| B. | 标准状况下22.4LNO与11.2LO2混合后气体的分子数为2NA | |
| C. | 4.0gH2与足量O2完全反应生成水,反应中断裂共价键数目为2NA | |
| D. | 常温常压下,将0.1molFe投入足量浓硝酸中,转移电子数为0.3NA |
分析 A、在乙醇溶液中,除了乙醇中含H原子,水也含H原子;
B、标准状况下22.4LNO与11.2LO2混合后生成1mol二氧化氮气体,但NO2中存在平衡:2NO2?N2O4;
C、4.0g氢气的物质的量为:$\frac{4.0g}{2g/mol}$=2mol,2mol氢气与1mol氧气 恰好完全反应,断裂的共价键有2mol氢氢键、1mol氧氧键,总共断裂了3mol共价键;
D、常温常压下,铁在浓硝酸中钝化.
解答 解:A、10g质量分数为46%的乙醇溶液中含溶质乙醇质量=10g×46%=4.6g;含溶剂水质量=10g×(1-46%)=5.4g;所含氢原子物质的量=$\frac{4.6g}{46g/mol}$=1.2mol,故A正确;
B、标准状况下22.4LNO与11.2LO2混合后生成1mol二氧化氮气体,但NO2中存在平衡:2NO2?N2O4,导致分子个数减少,故所得的分子个数小于2NA个,故B错误;
C、4g氢气的物质的量为2mol,2mol氢气完全反应消耗1mol氧气,二者完全反应需要断裂2mol氢氢键、1mol氧氧键,总共断裂3mol共价键,反应中断裂共价键的总数为3NA,故C错误;
D、常温常压下,铁在浓硝酸中钝化,反应程度很小,故转移的电子数小于0.3NA个,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:多选题
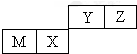
| A. | 离子半径Z<Y<M | |
| B. | X的氧化物能与水反应生成相应的酸 | |
| C. | 气态氢化物的稳定性:Z>Y>X | |
| D. | Y的最高价氧化物对应的水化物属于共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 试剂(或条件) | ||
| A | 用温度的变化鉴别二氧化氮和溴蒸气 | ①热水浴 | ②冷水浴 |
| B | 用Na块检验乙醇分子中存在不同于烃分子里的氢原子 | ①乙醇 | ②己烷 |
| C | 用不同的有色物质比较二氧化硫和氯水漂白性的差异 | ①石蕊 | ②品红 |
| D | 用溴水检验苯的同系物中烷基对苯环有影响 | ①苯 | ②甲苯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液中可能大量存在Fe3+、K+、Cl-、SO42- | |
| B. | 标准状况下,将1.12 L CO2气体通入1 L 0.1 mol/L的NaAlO2溶液中:CO2+2H2O+AlO2-═Al(OH)3↓+HCO3- | |
| C. | 由水电离出的c(H+)=1×10-12 mol/L 的溶液中可能大量存在K+、I-、Mg2+、NO3- | |
| D. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═NH3•H2O+Al(OH)3↓+2BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
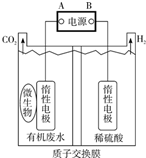 在微生物作用下,电解有机废水(含CH3COOH),实现废水处理的同时,可获得清洁能源H2.其原理如图所示.下列有关说法正确的是( )
在微生物作用下,电解有机废水(含CH3COOH),实现废水处理的同时,可获得清洁能源H2.其原理如图所示.下列有关说法正确的是( )| A. | 电极A为负极 | |
| B. | 电解中生成的CO2与H2物质的量之比为1:1 | |
| C. | 阳极反应为:CH3COOH一8e-+8OH-═2CO2↑+6H2O | |
| D. | 电解前后,阴极室的pH几乎保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 青蒿素是抗疟特效药,属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有(不考虑立体异构)( )
青蒿素是抗疟特效药,属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有(不考虑立体异构)( )| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
查看答案和解析>>
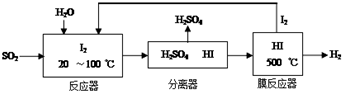
科目:高中化学 来源: 题型:解答题

| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| Ksp | 8.0×10-16 | 4.0×10-38 | 3.0×10-17 | 2.2×10-20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该装置实现化学能向电能的转化 | |
| B. | 该电池的总反应为2NO+O2═2NO2 | |
| C. | 当有2.24L的O2参与反应时,转移了0.4mole- | |
| D. | NiO电极的电极反应式:NO+O2--2e-═NO2 |
查看答案和解析>>
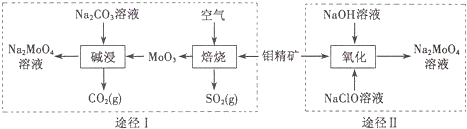
科目:高中化学 来源: 题型:解答题
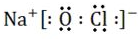 .
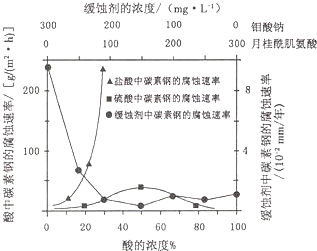
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com