
| A. | 1:6 | B. | 2:15 | C. | 2:3 | D. | 16:25 |
分析 根据FeS化学式可知,溶液中铁离子与硫酸根离子的物质的量相等,令参加反应的FeS为1mol,则溶液中Fe2(SO4)3为$\frac{1}{3}$mol,Fe(NO3)3为$\frac{1}{3}$mol,反应中Fe元素、S元素化合价升高,N元素化合价降低,根据电子转移守恒计算NO2、N2O4、NO各的物质的量,进而计算起氧化剂作用的HNO3,参加反应的硝酸为起氧化剂作用的硝酸与起酸作用的硝酸之和,据此计算.
解答 解:令参加反应的FeS为1mol,则溶液中Fe2(SO4)3为$\frac{1}{3}$mol,Fe(NO3)3为$\frac{1}{3}$mol,
反应中Fe元素、S元素化合价升高,N元素化合价降低,令NO2、N2O4、NO的物质的量分别为4amol、amol、4amol,根据电子转移守恒有:1×(3-2)+1×[6-(-2)]=4a×(5-4)+a×(5-4)×2+4a×(5-2),解得a=0.5,故NO2、N2O4、NO的物质的量分别为2mol、0.5mol、2mol,故起氧化剂作用的HNO3为2mol+0.5mol×2+2mol=5mol,起酸的作用的硝酸生成Fe(NO3)3,故起酸的作用的硝酸为$\frac{1}{3}$mol×3=1mol,参加反应的硝酸为5mol+1mol=6mol,故实际参加反应的FeS与HNO3的物质的量之比为1mol:6mol=1:6,
故选A.
点评 本题考查氧化还原反应有关计算,难度中等,利用电子转移守恒与元素守恒计算是关键,转移守恒思想在氧化还原反应计算中的运用.


科目:高中化学 来源: 题型:选择题
| A. | 1.01×105Pa,20℃时48g O3含有的原子数为3NA | |
| B. | 1molNa2O2晶体中阴离子数为2 NA | |
| C. | 标准状况下,相同体积的O2、HCl、H2O含有的分子数相同 | |
| D. | 等质量钠,在足量氧气中加热充分反应比在足量氧气(常温)中充分反应失去的电子多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| C. | 将氯化亚铁溶液和氯气反应:Fe2++Cl2═Fe3++2 Cl- | |
| D. | 将铜屑加入含Fe3+的溶液中:2Fe3++Cu═2Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2(CO):点燃 | |
| B. | 硝酸钾(氯化钠):浓溶液降温结晶 | |
| C. | MgSO4(MgCl2):蒸干、灼烧 | |
| D. | 乙酸(乙醛):加新制氢氧化铜浊液加热,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
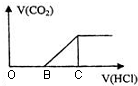 向NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同.若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图.则下列分析正确的是(不计CO2溶解)( )
向NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同.若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图.则下列分析正确的是(不计CO2溶解)( )| A. | 若OB=0,则溶液M为Na2CO3溶液 | |
| B. | 若OB=BC,则形成溶液M所发生反应的离子方程式为OH-+CO2→HCO3- | |
| C. | 若溶液M中c(NaHCO3)=2c(Na2CO3),则3OB=BC | |
| D. | 若溶液M中大量存在的阴离子为CO32-和HCO3-,则OB>BC |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ | |
| B. | 强酸性溶液中:Na+、K+、NO3-、SiO32- | |
| C. | 可与Al反应放出氢气的溶液中:Na+、Ca2+、Cl-、HCO3- | |
| D. | 使石蕊变蓝的溶液中:Ba2+、Na+、AlO2-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
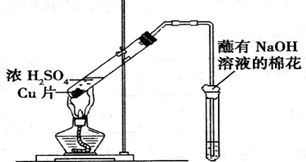
| 试管中试剂 | 试管中现象 | 解 释 | |
| A | 硝酸酸化的BaCl2溶液 | 生成白色沉淀 | 白色沉淀为BaSO3 |
| B | 品红溶液 | 溶液褪色 | SO2具有漂白性 |
| C | 紫色石蕊溶液 | 溶液变红 | SO2水溶液显酸性 |
| D | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第七周期第IIIA族 | B. | 第七周期第VA族 | ||
| C. | 第七周期第IIIB族 | D. | 第七周期第VB族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com