
已知:SO2可以与硫酸酸化的浓KMnO4溶液反应,也可以使澄清的石灰水变浑浊。下图④中浓硫酸与木炭粉在加热条件下发生反应生成 CO2、SO2和H2O。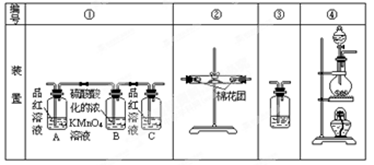
(1)在加热条件下,浓硫酸与木炭粉反应的化学方程式是: 。(2分)
(2)若用上图所列各装置设计一个实验,验证浓硫酸与木炭粉反应的产物,这些装置的连接顺序
(按产物气流从左至右的方向)是(填装置的编号) → → → 。(2分)
(3)B瓶溶液的作用是 。(2分)本实验中能说明二氧化硫具有漂白性的实验现象是 。(2分)③中反应的离子方程式为 。(2分)
(4)装置②中所盛是无水硫酸铜,现象是 。(2分)
(1)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O (2)④②①③
CO2↑+2SO2↑+2H2O (2)④②①③
(3)除去SO2;A中品红溶液褪色;CO2+Ca2++2OH-=H2O+CaCO3↓
(4)由白色变为蓝色
解析试题分析:(1)浓硫酸具有强氧化性,在加热的条件下与木炭发生反应的化学方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
(2)浓硫酸与木炭共热化学方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O,生成CO2、SO2和H2O,依次检验CO2、SO2和H2O的存在时,应先检验水蒸气的存在,因为在验证二氧化碳、二氧化硫的存在时都需通过溶液,可带出水蒸气;二氧化碳、二氧化硫都能使澄清的石灰水变浑浊,所以不能先通过澄清的石灰水来检验二氧化碳的存在,所以先检验二氧化硫的存在并除去二氧化硫后才检验二氧化碳的存在,即检验过程应为检验水蒸气→检验并除尽二氧化硫→检验二氧化碳;无水硫酸铜为白色固体,遇水变蓝,可用于检验水;SO2能使红色的品红溶液褪色,CO2不能使红色的品红溶液褪色,因此装置A中盛有红色的品红溶液来检验二氧化硫;二氧化硫影响二氧化碳的检验,因此检验二氧化碳前先除尽二氧化硫,装置B中盛有的酸性高锰酸钾溶液除去二氧化硫,而不除去二氧化碳,装置C中的红色的品红溶液是用来证明SO2气体已完全除尽的;二氧化碳的检验方法为通过澄清的石灰水,使澄清的石灰水变浑浊,所以正确的连接顺序为④②①③。
CO2↑+2SO2↑+2H2O,生成CO2、SO2和H2O,依次检验CO2、SO2和H2O的存在时,应先检验水蒸气的存在,因为在验证二氧化碳、二氧化硫的存在时都需通过溶液,可带出水蒸气;二氧化碳、二氧化硫都能使澄清的石灰水变浑浊,所以不能先通过澄清的石灰水来检验二氧化碳的存在,所以先检验二氧化硫的存在并除去二氧化硫后才检验二氧化碳的存在,即检验过程应为检验水蒸气→检验并除尽二氧化硫→检验二氧化碳;无水硫酸铜为白色固体,遇水变蓝,可用于检验水;SO2能使红色的品红溶液褪色,CO2不能使红色的品红溶液褪色,因此装置A中盛有红色的品红溶液来检验二氧化硫;二氧化硫影响二氧化碳的检验,因此检验二氧化碳前先除尽二氧化硫,装置B中盛有的酸性高锰酸钾溶液除去二氧化硫,而不除去二氧化碳,装置C中的红色的品红溶液是用来证明SO2气体已完全除尽的;二氧化碳的检验方法为通过澄清的石灰水,使澄清的石灰水变浑浊,所以正确的连接顺序为④②①③。
(3)根据以上分析可知B瓶溶液的作用是除去SO2;本实验中能说明二氧化硫具有漂白性的实验现象是A中品红溶液褪色;③中反应的离子方程式为CO2+Ca2++2OH-=H2O+CaCO3↓。
(4)硫酸铜吸水变为胆矾,则装置②中所盛是无水硫酸铜,现象是由白色变为蓝色,
考点:考查浓硫酸与木炭反应产物检验的实验方案设计


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:实验题
树德中学某化学兴趣小组在实验室用MnO2与浓盐酸反应制备C12(发生装置如图所示)。
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是 序号)。
A.往烧瓶中加入浓盐酸
B.加热
C.往烧瓶中加入MnO2粉末
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,兴趣小组同学提出下列实验探究方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量
乙方案:采用酸碱恰好中和(有指示剂)的方法测定
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量
丁方案:与足量Zn反应,测量生成的H2体积(换算为标准状况)
继而进行下列判断和实验:
①判定甲方案是否可行 (填“是”或“否”),理由是 。
②进行乙方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00 mL,滴入0.200 0 mol/L的NaOH溶液,消耗NaOH溶液22.00 mL,该次测得试样中盐酸浓度为 mol·L一1;
b.重复以上操作多次取平均值获得实验结果
③判断丙方案的实验结果 (填“偏大"、“偏小”或“准确”)。
(已知:部分CaCO3会转化为更难溶的MnCO3)
④进行丁方案实验:装置如图所示(夹持器具已略去)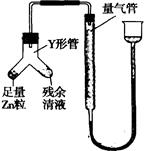
(i)使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中。
(ii)反应完毕,每间隔l分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是 (排除仪器和实验操作的影响因素)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。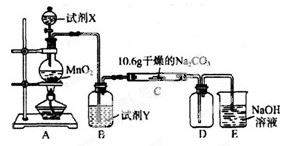
(1)写出装置A中发生反应的离子方程式: 。
(2)写出试剂Y的名称_____________________。
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物。可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究。
①提出合理假设:
假设一:存在两种成分:NaHCO3和__________
假设二:存在三种成分:NaHCO3和__________、__________。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 | |
| 步骤2:向A试管中滴加_________: | ①若无明显现象,证明固体中不含碳酸钠; ②若溶液变浑浊,证明固体中含有碳酸钠。 |
| 步骤3:向B试管中滴加________: | 若溶液变浑浊,结合步骤2中的①,则假设一成立:结合步骤2中的②,则假设二成立。 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用过量的碳还原二氧化硅制得粗硅,同时得到一种可燃性气体;
②粗硅与干燥的HCl气体反应制得SiHCl3(Si+3HCl SiHCl3+H2);
SiHCl3+H2);
③SiHCl3与过量的H2在1 100~1 200 ℃的温度下反应制得纯硅,已知SiHCl3能与水剧烈反应,在空气中易自燃。
请回答:
(1)第一步制取粗硅的化学反应方程式为 。
(2)粗硅与HCl气体反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为 。
(3)实验室用SiHCl3与过量的H2反应制取纯硅装置如图所示(加热和夹持装置略去):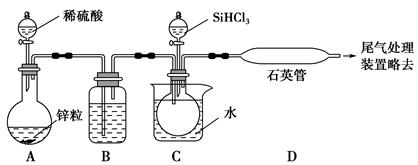
①装置B中的试剂是 ,装置C中的烧杯需要加热,目的是 。
②反应一段时间后,装置D中观察到的现象是 ,装置D不能采用普通玻璃管的原因是 ,装置D中发生反应的化学方程式是 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(1)某兴趣小组在实验室探究工业合成硝酸的化学原理。
①氨的催化氧化:图a是探究氨的催化氧化的简易装置,实验中观察到锥形瓶中铂丝保持红热,有红棕色气体生成或白烟产生。白烟的成分是 (填化学式)。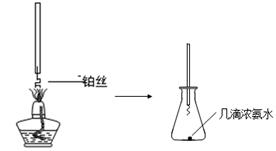
图a 图b
②NO2的吸收:如图b所示,将一瓶NO2倒置于水槽中,在水下移开玻璃片,可观察到的现象是 。
(2)三价铁盐溶液因Fe3+水解而显棕黄色,请以Fe(NO3)3溶液为例,设计实验探究影响盐类水解程度的因素。
①写出Fe(NO3)3水解的离子方程式 。
②参照示例完成下表实验方案的设计。
限选材料:0.05mol?L-1Fe(NO3)3、0.5mol?L-1Fe(NO3)3、1.0mol?L-1HNO3、1.0mol?L-1NaOH、NaHCO3固体、蒸馏水、冰水混合物;pH计及其他常见仪器。
| 可能影响因素 | 实验操作 | 预期现象和结论 |
| 溶液的酸碱性 | 取少量0.5mol?L-1Fe(NO3)3于试管中,加入几滴1mol?L-1HNO3。 | 棕黄色溶液颜色变浅,说明溶液酸性增强能抑制Fe(NO3)3的水解。 |
| 盐的浓度 | | |
| | | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
CaCO3广泛存在于自然界,是一种重要的化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。
完成下列填空:
(1)用浓盐酸配制1∶1(体积比)的稀盐酸(约6 mol·L-1),应选用的仪器是 。
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶
(2)上述装置中,A是 ,NaHCO3溶液可以吸收 。
(3)上述装置中,B物质是 。用这个实验得到的气体测定CO2的相对分子质量,如果B物质失效,测定结果 (填“偏高”、“偏低”或“不受影响”)。
(4)一次性饭盒中石蜡(高级烷烃)和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:
剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重
为了将石蜡和碳酸钙溶出,应选用的试剂是 。
a.氯化钠溶液 b.稀醋酸 c.稀硫酸 d.正己烷
(5)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出 ,后溶出 。
(6)上述测定实验中,连续 ,说明样品已经恒重。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室里常见到如图所示仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄。该仪器可进行多项实验,当玻璃管内装有碘晶体时,用此仪器可进行碘升华实验,具有装置简单,操作方便,现象明显,没有污染,可反复使用等优点。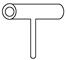
(1)用此仪器不能反复进行的实验是 。
A.NH4Cl固体受热分解
B.KMnO4晶体受热分解
C.白磷和红磷在一定温度下互相转变
(2)如果玻璃管内装有某种红色溶液,加热时溶液颜色变浅,冷却时恢复红色,该溶液可能是 ;如果玻璃管内封有无色溶液,加热溶液时,溶液变红,冷却后恢复原颜色,此溶液可能是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室用装置Ⅰ制氨气和氧气的混合气体,A中装有浓氨水,C中盛有碱石灰;用装置Ⅱ
验证氨的某些性质,D内放置催化剂(铂石棉),按气流方向①→②→③→④连接各仪器。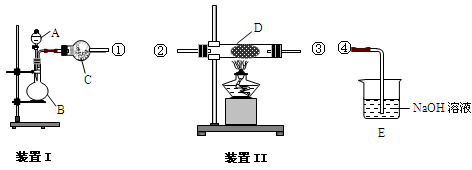
请回答下列问题:
(1)①仪器A的名称是 ,仪器B中应加入的固体药品 (填化学式);
②实验中观察到D内红棕色气体的化学式为 ,证明氨气具有 性;
(2)若用装置Ⅰ制取干燥的SO2气体,则:
①B中发生反应的化学反应方程式为 ;
②此时仪器C中改为盛装P2O5 的作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某中学化学实验小组为了证明和比较SO2和氯水的漂白性,设计了如图所示装置: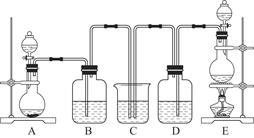
(1)实验室常用装置E制备Cl2,指出该反应中浓盐酸所表现出的特质有________________。
(2)反应开始后,发现B、D两个集气瓶中的品红溶液都褪色,停止通气后,用热水浴给B、D两个集气瓶加热。两个集气瓶中的现象分别为:B____________________;D____________________。
(3)装置C的作用是______________________________________________________。
(4)该实验小组的甲、乙两位同学利用上述两个发生装置按图所示装置继续进行实验: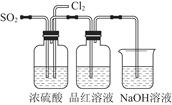
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。
试根据该实验装置和两名同学的实验结果回答问题:
①指出在气体进入品红溶液之前,先将SO2和Cl2通过浓硫酸中的目的:________________________________________________________________________________________________________________________________________________。
②试分析甲同学实验过程中,品红溶液不褪色的原因是____________________________________________________________________________________________________________________________________________________________________________________________________________________。(结合离子方程式说明)
③你认为乙同学是怎样做到让品红溶液变得越来越浅的?
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com