
| A. | 反应完全停止 | B. | 各物质的浓度保持不变 | ||
| C. | 反应物消耗完全 | D. | 正反应速率大于逆反应速率 |
分析 一定条件下,乙烷发生分解反应:C2H6?C2H4+H2.一段时间后,各物质的浓度保持不变说明反应达到平衡状态,正逆反应速率相同,各组分含量保持不变.
解答 解:一定条件下,乙烷发生分解反应:C2H6?C2H4+H2.一段时间后,各物质的浓度保持不变说明反应达到平衡状态,
A.化学平衡是动态平衡,反应只是正逆反应速率相同,反应未停止,故A错误;
B.浓度不变说明反应达到平衡状态,故B正确;
C.反应是可逆反应不能进行彻底,故C错误;
D.达到平衡状态正逆反应速率相同,故D错误;
故选B.
点评 本题考查了化学反应达到平衡状态的标志,注意平衡状态正逆反应速率相同,各组分含量保持不变,是动态平衡,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期的实验现象和结论 |
| 步骤:取一定量的固体产物于试管中,加入适量蒸馏水进行溶解,然后往试管中加入适量的 CuCl2溶液并过滤. | \ |
| 步骤2: 取1的滤液加入酚酞试液,若溶液变红, | 说明有NaOH |
| 步骤3: 取1的滤液加入BaCl2溶液,若产生白色沉淀, | 说明有Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
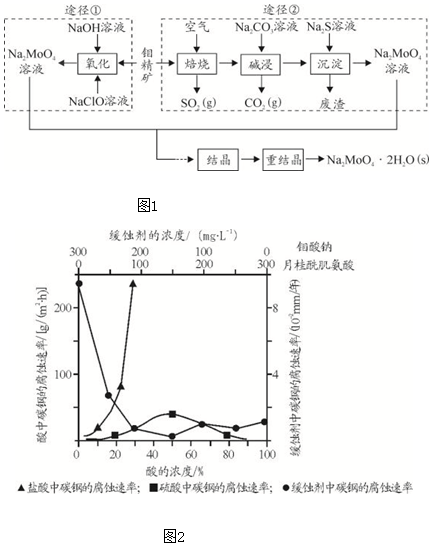

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 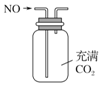 用图所示装置(正放)可收集NO气体 | |
| B. | 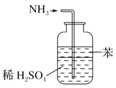 用图所示装置可吸收多余氨气且能防止倒吸 | |
| C. | 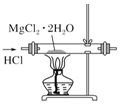 用装置制取无水MgCl2 | |
| D. | 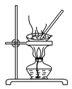 用装置蒸干NH4Cl饱和溶液获取NH4Cl晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 都能作干燥剂 | B. | 都具有一定的氧化性 | ||
| C. | 加热时都能与铜发生反应 | D. | 在常温下都能用铁制容器贮存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,4.48 L重水(D2O)中含有的中子数为2NA | |
| B. | 0.1mol乙烯和乙醇(C2H5OH,蒸汽)混合物完全燃烧所消耗的氧分子数一定为0.3NA | |
| C. | 常温常压下,15g乙烷分子中含有的共价键数目为3NA | |
| D. | 273K,101kPa下,14g乙烯与丙烯混合物中含有碳原子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构及性质 |
| A | A单质是生活中的常见金属,它有两种氯化物,相对分子质量相差35.5 |
| B | B原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| C | C是常见化肥的主要元素,单质常温下呈气态 |
| D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| E | 通常情况下,E没有最高正化合价,其单质之一是空气的一种主要成分 |
| F | F是周期表中元素原子半径最小的,其单质常温下是密度最小的气体 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com