
| 短周期元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的热稳定性:H2T<H2R | |
| B. | 单质与稀盐酸反应的速率:L<Q | |
| C. | 离子半径:R2-<L2+ | |
| D. | M与T形成的化合物既能与强酸反应,又能与强碱反应 |
分析 由表格中原子半径及化合价可知,T只有-2价,则T为O元素,R有-2和+6价,则R为S元素;L、M的原子半径均大于R、T,应均为第三周期元素,则L为Mg、M为Al,Q为第二周期第IIA族元素,则Q为Be,以此来解答.
解答 解:由上述分析可知,L为Mg,M为Al,Q为Be,R为S,T为O,
A.非金属性O大于S,则稳定性H2O>H2S,即H2T>H2R,故A错误;
B.金属性Mg比Be强,则Mg与酸反应越剧烈,则相同条件下单质与稀盐酸反应速率为L>Q,故B错误;
C.Mg2+离子核外电子数为10,S2-离子的核外电子数为18,电子层越多,原子半径越大,则离子半径:R2->L2+,故C错误;
D.M与T形成的化合物是氧化铝,属于两性氧化物,既能与强酸反应,又能与强碱反应,故D正确;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子半径、元素的化合价来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
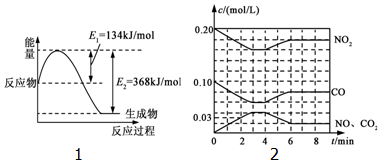 随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义.
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
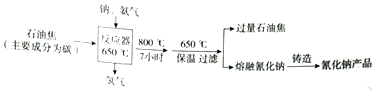

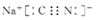 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将乙烯和乙炔气体分别通入溴的四氯化碳溶液中,两者都褪色 | |
| B. | 甲烷和氯气在室温下的光照环境中可以稳定存在 | |
| C. | 苯能使溴水褪色是因为二者反应生成了溴苯 | |
| D. | 要除去乙烷中的乙烯制得纯净的乙烷,将混合气体通入酸性高锰酸钾溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取碳酸钠晶体(Na2CO3•10H2O)100g来配制0.5mol/L的Na2CO3溶液1000mL | |
| B. | 配制NH3NO3溶液,在烧杯中溶解后立即注入容量瓶,并立即进行下面的各项操作 | |
| C. | 定容后,将容量瓶振荡均匀,静置时发现液面低于刻度线,于是又加入少量水至刻度线 | |
| D. | 容量瓶用蒸馏水洗净后未经干燥马上用来配制溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com