
| A. | 食盐 | B. | 石碱 | C. | 烧碱 | D. | 氧化钙 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn | B. | Cu | C. | Fe | D. | Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
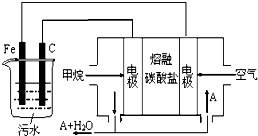 FeCl3具有净水作用,但腐蚀设备,所以工业上常选用电浮选凝聚法处理污水.其原理是保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.某课外小组用电浮选凝聚法处理污水,设计如图所示装置示意图.
FeCl3具有净水作用,但腐蚀设备,所以工业上常选用电浮选凝聚法处理污水.其原理是保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.某课外小组用电浮选凝聚法处理污水,设计如图所示装置示意图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
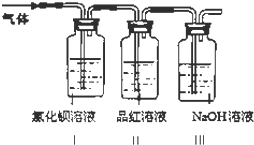 绿矾是一种重要的化工原料.
绿矾是一种重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4•5H2O | B. | FeSO4•7H2O | C. | KAl(SO4)2•12H2O | D. | Fe2(SO4)3•9H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com