
科目:高中化学 来源: 题型:
下列有关物质的应用与性质相对应的是
A.明矾能用于净水是冈为销离子水解生成的氢氰化销胶体具有强氰化性
B.氯化铁溶液可用于制作印刷电路板是冈为其能氰化铜
C.浓硫酸可用作干燥剂是冈为其具有强酸性
D.光导纤维可用作通讯材料是因为其具有导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
铍元素性质与铝元素性质相似,下列方法能证明氯化铍由共价键构成的是( )
A.溶于水加硝酸银溶液,观察是否有白色沉淀生成
B.溶于水做导电实验,观察是否导电
C.熔融状态,做导电实验,观察是否导电
D.测定氯化铍熔点
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是
A.贝采里乌斯提出了有机化学概念,维勒打破了无机物和有机物的界限,范特霍夫提出了有机化合物的三维结构。
B.同位素示踪法、比色分析法都是科学家经常使用的研究化学反应历程的手段之一。
C.降低能耗是重要的节能措施,可以通过合理设计工艺路线,优化工艺条件和研制性能优良的催化剂等来实现。
D.科学家将蛋白质的结构层次分为四级进行研究,蛋白质的二级结构主要依靠肽链中-NH-上的氢原子与羰基上的氧原子形成氢键而实现的。
查看答案和解析>>
科目:高中化学 来源: 题型:
将1.00 mol·L-1 NaOH溶液滴入20.00 mL 1.00 mol·L-1的一元酸HA溶液中,测得混合溶液的pH和温度随加入NaOH溶液体积变化曲线如图所示。
(1)计算室温时20.00 mL 1.00 mol·L-1的一元酸
HA的电离度α=________。
 (2)图中B点所示的溶液中所含各离子浓度由
(2)图中B点所示的溶液中所含各离子浓度由
大到小的顺序是_____。
(3)下列说法正确的是________(填相应序号)。
A.由图中可知NaOH和HA反应的ΔH>0
B.图中C点所加NaOH溶液的体积V=20.00 mL
C.图中C点时溶液的KW略大于1×10-14 mol·L-1,溶液中c(H+)=1×10-7 mol·L-1
D.图中D点后,溶液温度略下降的主要原因是生成的NaA水解吸热
(4)常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入
0.1 mol·L-1 HCl溶液40 mL,溶液中含碳元素的各种微粒
(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的
部分情况如图所示。]回答下列问题:
① 在同一溶液中,H2CO3、HCO 、CO
、CO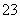
______(填“能”或“不能”)大量共存;
② 当pH=7时,溶液中含碳元素的主要微粒为________,溶液中各种离子的物质的量
浓度的大小关系为________________________________;
③ 已知在25 ℃时,CO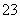 水解反应的平衡常数即水解常数Kh=2×10-4 mol·L-1,当溶
水解反应的平衡常数即水解常数Kh=2×10-4 mol·L-1,当溶
液中c(HCO )∶c(CO
)∶c(CO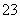 )=2∶1时,溶液的pH=________。
)=2∶1时,溶液的pH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是 ( )
A.1 mol CO2的质量是44g/mol B.铝离子的摩尔质量是27g
C. H2O的摩尔质量是18g/mol D.H2的相对分子质量是2g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
“3G”手机出现后,以光导纤维为基础的高速信息通道尤显重要。下列物质中用于制造光导纤维的材料是( )。
A.铜合金 B.陶瓷 C.聚乙烯 D.二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.N和As属于第VA族元素2,N原子得电子能力比As原子强
B.族序数等于其周期序数的元素一定是金属元素
C.元素周期表中,位于金属和非金属交界线附近的元素属于过渡元素
D.Si、S、Cl的最高价氧化物都能与水反应生成相应的酸,且酸性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,应先用 选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:

然后加入足量 溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中
溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中 的体积分数为 。
的体积分数为 。
[探究二]
分析上述实验中 体积分数的结果,丙同学认为气体Y中还可能含量有
体积分数的结果,丙同学认为气体Y中还可能含量有 和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。

(3)装置B中试剂的作用是 。
(4)认为气体Y中还含有Q的理由是 (用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于 (选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有 ,预计实验现象应是 。
,预计实验现象应是 。
(7)若要测定限定体积气体Y中 的含量(标准状况下约有28ml
的含量(标准状况下约有28ml ),除可用测量
),除可用测量 体积的方法外,可否选用质量称量的方法?做出判断并说明理由 。
体积的方法外,可否选用质量称量的方法?做出判断并说明理由 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com