
| A. | X原子的电子层比Y原子的电子层数多 | |
| B. | X原子的最外层电子比Y原子的最外层电子多 | |
| C. | X的单质能将Y从NaY的溶液中置换出来 | |
| D. | Y的单质能将X从NaX的溶液中置换出来 |
分析 根据判断非金属性强弱的方法:①单质与氢气易(难)反应;②生成的氢化物稳定(不稳定);③最高价氧化物的水化物(含氧酸)酸性强(弱);④相互置换反应(强制弱)来回答.
解答 解:A、X原子的电子层比Y原子的电子层数多,不能说明X的非金属性比Y强,如Na和F,Na的电子层数多,但是F的非金属性强,电子层的多少不能证明非金属性的强弱,故A错误;
B、X原子的最外层电子比Y原子的最外层电子多,不能说明X的非金属性比Y强,如O的非金属性强于I,故B错误;
C、X的单质能将Y从NaY的溶液中置换出来,证明X的非金属性比Y强,故C正确;
D、Y的单质能将X从NaX的溶液中置换出来,证明X的非金属性比Y弱,故D错误.
故选C.
点评 本题考查学生判断元素非金属性强弱的方法,可以根据所学知识进行回答,难度较大.


科目:高中化学 来源: 题型:解答题
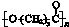 .其合成路线如下.
.其合成路线如下.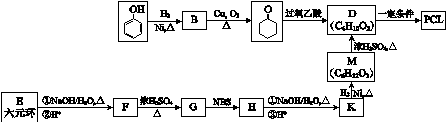
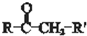 $\stackrel{过氧乙酸}{→}$
$\stackrel{过氧乙酸}{→}$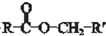 ②R-CH=CH-CH3$\stackrel{NBS}{→}$R-CH=CH-CH3Br
②R-CH=CH-CH3$\stackrel{NBS}{→}$R-CH=CH-CH3Br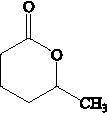 .
. .
.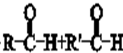
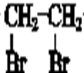 $→_{△}^{NaOH水溶液}$
$→_{△}^{NaOH水溶液}$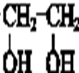
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
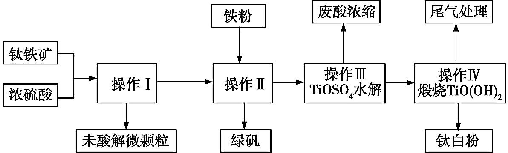
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能发生丁达尔效应的分散系有氯化钠溶液、水等 | |
| B. | 根据分散系的稳定性,将分散系分为胶体、浊液和溶液 | |
| C. | 可吸入颗粒(如硅酸盐粉尘)能形成气溶胶,对人类的健康危害极大 | |
| D. | FeCl3溶液与Fe(OH)3胶体的本质区别是有无丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
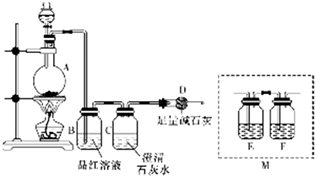
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠是既有氧化性又有还原性的淡黄色固体 | |
| B. | 铝箔在酒精灯上灼烧可观察到内部熔化但不滴落,说明铝的熔点高 | |
| C. | SiO2属于酸性氧化物,能和水化合生成硅酸 | |
| D. | 二氧化硅可以用来作太阳能电池的材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com