

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
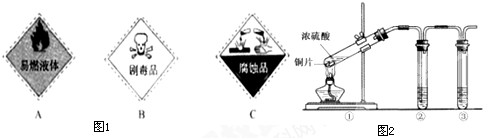
(15分)硫酸是一种实验室常用的化学试剂。请按要求填空:
(1)浓硫酸试剂瓶上适合贴上的图标是 (填写字母标号)。
(2)实验室有1.00mol·L-1的硫酸溶液,从中准确量出10.00 mL,其物质的量浓度为 mol·L-1。现将准确量出的10.00mL的硫酸溶液配制成0.100mol·L-1的稀硫酸,所需要的玻璃仪器除烧杯、玻璃棒还需 和 。在配制过程中定容时俯视,则所配溶液浓度 (填“偏大”或“偏小”或“无影响”)
(3)用右上图所示的实验装置②验证铜与浓硫酸反应生成的气体产物,则装置②、③中试剂依次为下列的 和
A.品红溶液 B.BaCl2溶液 C.NaOH溶液 D.AgNO3溶液
(4)装置①中发生反应的化学方程式为 若装置①中加入铜6.4g和含有0.2molH2SO4的浓硫酸,则产生二氧化硫质量
A. 等于6.4克 B.大于6.4克 C.小于6.4克 D.不能确定
(5)若将装置①中的铜片换成木炭,装置②试管内为氢硫酸溶液, 装置③试管内为澄清石 灰水,则装置①中发生反应的化学方程式为 。装置②中主要反应的氧化剂和还原剂物质的量之比是 。根据装置③观察到有白色沉淀生成的现象 (填“能”或“不能”)判断该白色沉淀一定只有CaCO3。
查看答案和解析>>
科目:高中化学 来源:2010年安徽师大附中高二第二学期期中考查 题型:填空题
(14分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。
图1 图2
(1)取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示。
①请在下图的方框中画出上述反应的速率与时间的关系曲线。(请在图上标明相应的数值)
|
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省三明市普通高中高一上学期联合命题考试化学试卷 题型:实验题
(15分)硫酸是一种实验室常用的化学试剂。请按要求填空:
(1)浓硫酸试剂瓶上适合贴上的图标是 (填写字母标号)。
(2)实验室有1.00mol·L-1的硫酸溶液,从中准确量出10.00 mL,其物质的量浓度为 mol·L-1。现将准确量出的10.00 mL的硫酸溶液配制成0.100mol·L-1的稀硫酸,所需要的玻璃仪器除烧杯、玻璃棒还需 和 。在配制过程中定容时俯视,则所配溶液浓度 (填“偏大”或“偏小”或“无影响”)
(3)用上图所示的实验装置②验证铜与浓硫酸反应生成的气体产物,则装置②、③中试剂依次为下列的 和
A.品红溶液 B.BaCl2溶液 C.NaOH溶液 D.AgNO3溶液
(4)装置①中发生反应的化学方程式为 若装置①中加入铜6.4g和含有0.2molH2SO4的浓硫酸,则产生二氧化硫质量
A.等于6.4克 B.大于6.4克 C.小于6.4克 D.不能确定
(5)若将装置①中的铜片换成木炭,装置②试管内为氢硫酸溶液, 装置③试管内为澄清石 灰水,则装置①中发生反应的化学方程式为 。装置②中主要反应的氧化剂和还原剂物质的量之比是 。根据装置③观察到有白色沉淀生成的现象 (填“能”或“不能”)判断该白色沉淀一定只有CaCO3。
查看答案和解析>>
科目:高中化学 来源:2014届福建省高一第一学期联合命题考试化学试卷 题型:实验题
(15分)硫酸是一种实验室常用的化学试剂。请按要求填空:
(1)浓硫酸试剂瓶上适合贴上的图标是 (填写字母标号)。

(2)实验室有1.00mol·L-1的硫酸溶液,从中准确量出10.00 mL,其物质的量浓度为 mol·L-1。现将准确量出的10.00 mL的硫酸溶液配制成0.100mol·L-1的稀硫酸,所需要的玻璃仪器除烧杯、玻璃棒还需 和 。在配制过程中定容时俯视,则所配溶液浓度 (填“偏大”或“偏小”或“无影响”)
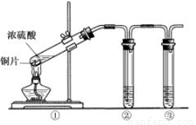
(3)用右上图所示的实验装置②验证铜与浓硫酸反应生成的气体产物,则装置②、③中试剂依次为下列的 和
A.品红溶液 B.BaCl2溶液 C.NaOH溶液 D.AgNO3溶液
(4)装置①中发生反应的化学方程式为 若装置①中加入铜6.4g和含有0.2molH2SO4的浓硫酸,则产生二氧化硫质量
A. 等于6.4克 B.大于6.4克 C.小于6.4克 D.不能确定
(5)若将装置①中的铜片换成木炭,装置②试管内为氢硫酸溶液, 装置③试管内为澄清石 灰水,则装置①中发生反应的化学方程式为 。装置②中主要反应的氧化剂和还原剂物质的量之比是 。根据装置③观察到有白色沉淀生成的现象 (填“能”或“不能”)判断该白色沉淀一定只有CaCO3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com