
| A. | C2H4 | B. | CH4 | C. | C2H2 | D. | C2H6 |
分析 二氧化碳的物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,水的物质的量为$\frac{3.6g}{18g/mol}$=0.2mol,结合烃的燃烧反应中原子守恒计算.
解答 解:二氧化碳的物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,水的物质的量为$\frac{3.6g}{18g/mol}$=0.2mol,由原子守恒可知,烃中含C为$\frac{0.2mol}{0.1mol}$=2,含H为$\frac{0.2mol×2}{0.1}$=4,则烃为C2H4,
故选A.
点评 本题考查有机物分子式计算的确定,为高频考点,把握物质的量的计算、原子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 钢铁的电化学腐蚀和化学腐蚀往往同时发生 | |
| B. | 加入合适的催化剂,能降低反应活化能,从而改变反应的焓变 | |
| C. | 常温下,pH为5的氯化铵溶液和pH为9的醋酸钠溶液中水的电离程度不同 | |
| D. | 向BaSO4沉淀中加入饱和Na2CO3溶液后生成BaCO3,则Ksp(BaCO3)<Ksp(BaSO4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 加入试剂 | 稀硫酸 | 浓硫酸、加热 | 稀硝酸 | 浓硝酸 |
| 实验现象 | 红色固体和蓝色溶液 | 无色气体和蓝色溶液 | 无色气体和蓝色溶液 | 红棕色气体和蓝色溶液 |
| A. | Cu | B. | Cu2O | ||
| C. | 一定有Cu,可能有Cu2O | D. | 一定有Cu2O,可能有Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
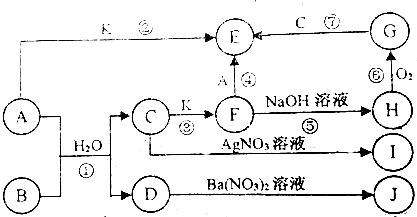
| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成 蓝 | Cl2+2I-=I2+2Cl- |
| 继续通入气体 | 溶液逐渐变成无色 | 5Cl2+I2+6H2O=2HIO3+10HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
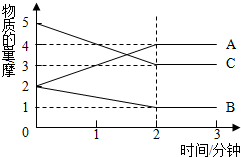 在容积为2升的密闭容器中,进行某可逆反应,反应过程中各物质的量的变化情况如图所示,其中A、B、C都为气体.则该反应的化学方程式为2C+B?2A.
在容积为2升的密闭容器中,进行某可逆反应,反应过程中各物质的量的变化情况如图所示,其中A、B、C都为气体.则该反应的化学方程式为2C+B?2A.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H8O2的酯有4种结构 | |
| B. | 淀粉和纤维素互为同分异构体 | |
| C. | 乙醇和葡萄糖均能发生酯化反应 | |
| D. | 用氢氧化钠溶液可以鉴别地沟油和矿物油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
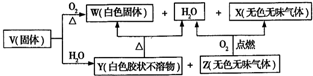
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.7g OH- 所含电子数为0.9NA | |
| B. | 标准状况下,11.2 L HCl 所含质子数为18NA | |
| C. | 常温下,11.2 L Cl2 气所含原子数为NA | |
| D. | 0.5 mol D2O 中所含质子数为5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com