
如何除去下列物质中含有的少量杂质?
(1)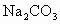 不混有
不混有
(2) 中混有
中混有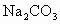
(3)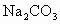 中混有
中混有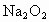
(4)NaCl溶液中混有
(5)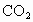 中混有HCl
中混有HCl
(6)NaOH溶液中混有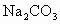
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
氯碱厂电解饱和食盐水溶液制取NaOH的工艺流程示意图如下:

依据上图,完成下列填空:
(1)在电解过程中化学反应方程式为 ,与电源负极相连的电极附近收集到的气体是 。
(2)如果粗盐中SO42—含量较高,必须添加钡试剂除去SO42—,该钡试剂可以是 。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2 D.BaSO4
(3)如何除去粗盐中含有的CaCl2、MgCl2及Na2SO4(实际上是指Ca2+、Mg2+及 SO42-),具体操作有: A、过滤 B、加足量的BaCl2溶液 C、加适量的稀盐酸
D、加足量的NaOH溶液 E、加足量的Na2CO3溶液
具体操作的顺序为
(4)脱盐工序中,通过加热浓缩、冷却、过滤的方法除去NaCl,该方法利用的是NaOH与NaCl这两物质在 上的性质差异。
(5)用隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2和NaOH反应;若采用无隔膜电解冷的食盐水,Cl2和NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
氯碱厂电解饱和食盐水溶液制取NaOH的工艺流程示意图如下:

依据上图,完成下列填空:
(1)在电解过程中化学反应方程式为 ,与电源负极相连的电极附近收集到的气体是 。
(2)如果粗盐中SO42—含量较高,必须添加钡试剂除去SO42—,该钡试剂可以是 。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2 D.BaSO4
(3)如何除去粗盐中含有的CaCl2、MgCl2及Na2SO4(实际上是指Ca2+、Mg2+及 SO42-),具体操作有: A、过滤 B、加足量的BaCl2溶液 C、加适量的稀盐酸
D、加足量的NaOH溶液 E、加足量的Na2CO3溶液
具体操作的顺序为
(4)脱盐工序中,通过加热浓缩、冷却、过滤的方法除去NaCl,该方法利用的是NaOH与NaCl这两物质在 上的性质差异。
(5)用隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2和NaOH反应;若采用无隔膜电解冷的食盐水,Cl2和NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2010年上海市吴淞中学高一上学期期中考试化学试卷 题型:填空题
氯碱厂电解饱和食盐水溶液制取NaOH的工艺流程示意图如下: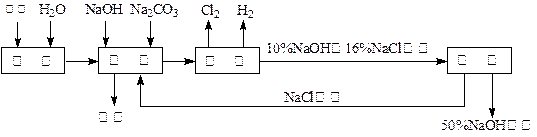
依据上图,完成下列填空:
(1)在电解过程中化学反应方程式为 ,与电源负极相连的电极附近收集到的气体是 。
(2)如果粗盐中SO42—含量较高,必须添加钡试剂除去SO42—,该钡试剂可以是 。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2 D.BaSO4
(3)如何除去粗盐中含有的CaCl2、MgCl2及Na2SO4(实际上是指Ca2+、Mg2+及 SO42-),具体操作有: A、过滤 B、加足量的BaCl2溶液 C、加适量的稀盐酸
D、加足量的NaOH溶液 E、加足量的Na2CO3溶液
具体操作的顺序为
(4)脱盐工序中,通过加热浓缩、冷却、过滤的方法除去NaCl,该方法利用的是NaOH与NaCl这两物质在 上的性质差异。
(5)用隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2和NaOH反应;若采用无隔膜电解冷的食盐水,Cl2和NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2010年上海市高一上学期期中考试化学试卷 题型:填空题
氯碱厂电解饱和食盐水溶液制取NaOH的工艺流程示意图如下:
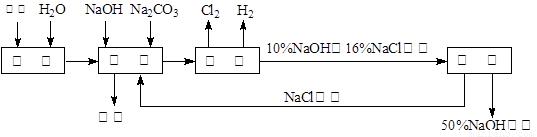
依据上图,完成下列填空:
(1)在电解过程中化学反应方程式为 ,与电源负极相连的电极附近收集到的气体是 。
(2)如果粗盐中SO42—含量较高,必须添加钡试剂除去SO42—,该钡试剂可以是 。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2 D.BaSO4
(3)如何除去粗盐中含有的CaCl2、MgCl2及Na2SO4(实际上是指Ca2+、Mg2+及 SO42-),具体操作有: A、过滤 B、加足量的BaCl2溶液 C、加适量的稀盐酸
D、加足量的NaOH溶液 E、加足量的Na2CO3溶液
具体操作的顺序为
(4)脱盐工序中,通过加热浓缩、冷却、过滤的方法除去NaCl,该方法利用的是NaOH与NaCl这两物质在 上的性质差异。
(5)用隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2和NaOH反应;若采用无隔膜电解冷的食盐水,Cl2和NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
如何除去下列物质中所含少量的杂质?写出所需试剂、分离方法及所用仪器。
混合物 | 所用试剂 | 分离方法 | 使用仪器 |
①肥皂水(甘油) |
|
|
|
②乙酸乙酯(乙酸) |
|
|
|
③硬脂酸(硬脂酸钠) |
|
|
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com