
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为:CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显色_________。
(2)能说明第①步反应达平衡状态的是___________。
A.Cr2O72-和CrO42-的浓度相同 B.2v(Cr2O72-)=v(CrO42-) C.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要_________mol的FeSO47H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH)=1032,要c(Cr3+)降至105mol/L,溶液的pH应调至_________________。
Cr3+(aq)+3OH(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH)=1032,要c(Cr3+)降至105mol/L,溶液的pH应调至_________________。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为____________。
(6)在阴极附近溶液pH升高的原因是__________(用电极反应解释),溶液中同时生成的沉淀还有_____________。
【答案】橙 C 6 5 阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+ 2H++2e-=H2↑ Fe(OH)3
【解析】
(1)根据外界条件对平衡的影响来确定平衡移动方向,从而确定溶液颜色变化;
(2)根据判断平衡状态的方法:V正=V逆,或各组分的浓度保持不变则说明已达平衡,也可根据化学平衡状态的特征:逆、定、动、变、等来回答判断;
(3)在氧化还原反应中,化合价升高值=化合价降低值=转移电子数来计算;
(4)根据Ksp=c(Cr3+)c3(OH-)来计算氢氧根离子离子的浓度,并计算氢离子浓度和pH的大小;
(5)阳极是活性电极时,阳极本身失电子,生成阳离子;
(6)溶液pH升高的原因是溶液中氢离子浓度减少,即氢离子在阴极得电子,pH升高,氢氧根离子浓度增大,离子浓度幂的乘积大于溶度积,所以金属阳离子会生成氢氧化物沉淀。
(1)pH=2说明溶液显酸性,c(H+)增大,平衡2CrO42-(黄色)+2H+Cr2O72-(橙色)+H2O右移,溶液呈橙色,故答案为:橙;
(2)对于平衡:2CrO42-(黄色)+2H+Cr2O72-(橙色)+H2O;
A.Cr2O72-和CrO42-的浓度相同,浓度可能还会发生变化,因此不一定为平衡状态,故A错误;
B.2υ(Cr2O72-)=υ(CrO42-)不能说明正、逆速率相等,不能说明是平衡状态,故B错误;
C.溶液的颜色不变,即有色离子浓度不会变化,说明Cr2O72—和CrO42—的浓度不再发生改变,说明达到了化学平衡状态,故C正确;
故答案为:C;
(3)还原1mol Cr2O72-离子,铬元素化合价从+6价降低到+3价,一共得到电子6mol,亚铁离子被氧化为+3价,应该失去6mol电子,所以还原1mol Cr2O72-离子,需要6mol的FeSO47H2O,故答案为:6;
(4)Cr(OH)3的溶度积Ksp=c(Cr3+)c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,则需c(OH-)=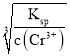 =
=![]() =10-9mol/L,所以c(H+)=10-5mol/L,即pH=5,故答案为:5;
=10-9mol/L,所以c(H+)=10-5mol/L,即pH=5,故答案为:5;
(5)在电解法除铬中,铁作阳极,阳极反应式为Fe-2e-═Fe2+,以提供还原剂Fe2+,故答案为:阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+;
(6)在电解池中阳离子在阴极得到电子,在溶液中由于H+得电子的能力强于Fe2+,因此阴极是H+放电,方程式为2H++2e-=H2↑,随着电解的进行,溶液中的H+浓度逐渐降低,水的电离被促进,OH-浓度逐渐升高。由于Fe2+被Cr2O72—氧化生成Fe3+,当溶液碱性达到一定程度时就会产生Fe(OH)3沉淀,故答案为:2H++2e-=H2↑;Fe(OH)3。


科目:高中化学 来源: 题型:
【题目】下列能用勒夏特列原理解释的是( )
A.H2、I2、HI平衡混合气加压后颜色变深
B.工业上由氢气和氮气合成氨是在较高温度下进行的
C.Fe(SCN)3溶液中加入固体KSCN后颜色变深
D.SO2催化氧化成SO3的反应,往往需要使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g) ΔH,2 min末达到平衡,生成0.8 mol D。
2C(g)+2D(g) ΔH,2 min末达到平衡,生成0.8 mol D。
(1)300 ℃时,该反应的平衡常数表达式为:K=_______。已知K300 ℃<K350 ℃,则ΔH______0(填“>”或“<”)。
(2)在2 min末时,B的平衡浓度为_______,D的平均反应速率为_______。
(3)若温度不变,缩小容器容积,则A的转化率______(填“增大” “减小”或“不变”),原因是_______。
(4)如果在相同的条件下,上述反应从逆反应方向进行,开始时加入C、D各4/3 mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关.
(1)下列生活用品中,其主要材料属于天然纤维的是_________(填字母序号);
A.塑料保鲜薄 B.橡胶手套 C.棉布围裙
(2)我们常用的洗涤剂清洗餐具上的油污,这是因为洗涤剂具有_________的功能;
(3)食用水果、蔬菜主要补充人体所需的_________;
(4)国家禁止在面粉中添加增白剂过氧化钙CaO2,过氧化钙中氧元素的化合价为_______;
(5)农业上降低土壤酸性的是_________(填化学式);
(6)生活中要用到大量的钢铁,写出赤铁矿(主要成分Fe2O3)冶炼成铁的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是
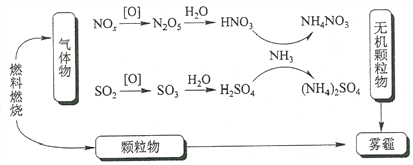
A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。
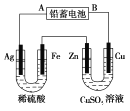
(1)A是铅蓄电池的___________极,铅蓄电池正极反应式为___________,放电过程中电解液的密度___________ (填“减小”、“增大”或“不变”)。
(2)Ag电极的电极反应式是___________,该电极的电极产物共____________g。
(3)Cu电极的电极反应式是____________,CuSO4溶液的浓度____________(填“减小”、“增大”或“不变”)
(4)如图表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示___________。
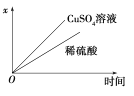
a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫为重要的含硫化合物,是形成酸雨的主要污染物之一。
(1)在实验室中,若用70%的硫酸溶液和亚硫酸钠粉末反应制取二氧化硫,并要求方便控制反应速率,可选用下图所示气体发生装置中的_____(填下列序号字母)。

(2)SO2经催化氧化可生成SO3,该反应的热化学方程式为:2SO2(g)+O2(g)![]() 2SO3(g) △H="a" kJ·mol-1;在T1℃时,将2 mol SO2、1mol O2充入容积为2 L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3 kJ,测得SO2的平衡转化率为50%,则a=_____,T1℃时,上述反应的平衡常数K1=____L·mol-1。若将初始温度为T1℃的2 mol SO2和1 molO2充入容积为2 L的绝热密闭容器B中,充分反应,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2。则K1______K2(填“>”、“<”或“=”)。
2SO3(g) △H="a" kJ·mol-1;在T1℃时,将2 mol SO2、1mol O2充入容积为2 L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3 kJ,测得SO2的平衡转化率为50%,则a=_____,T1℃时,上述反应的平衡常数K1=____L·mol-1。若将初始温度为T1℃的2 mol SO2和1 molO2充入容积为2 L的绝热密闭容器B中,充分反应,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2。则K1______K2(填“>”、“<”或“=”)。
(3)某热电厂上空大气中所含二氧化硫严重超标,现对该区域雨水样品进行探究。首先用pH试纸测定雨水样品的pH,操作方法为___________________________,测得样品pH约为3;为进一步探究由SO3所形成酸雨的性质,将一定量的SO2通入蒸馏水中,配成pH为3的溶液,然后将溶液分为A、B两份,向A中加入适量的NaOH固体,使溶液恰好呈中性(不考虑氧化性物质和其它酸性物质的影响),则此中性溶液中离子的浓度间存在的关系式为:[Na+]=______________;将溶液B久置于空气中,与久置前相比,久置后的溶液B中水的电离程度将__________(填“增大”、“减小”或“不变”)。
(4)工业上常用如下图所示的流程处理工业尾气中的SO2:

上述流程中有一种物质可以再生循环利用,该物质再生的化学方程式为_______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下。下列说法错误的是
B=11 | Al=27.4 | ?=68(甲) |
C=12 | Si=28 | ?=70(乙) |
N=14 | P=31 | As=75 |
O=16 | S=32 | Se=79.4 |
F=19 | Cl=35.5 | Br=80 |
A.元素甲位于现行元素周期表第四周期第ⅢA族
B.原子半径比较:甲![]() 乙
乙![]()
C.元素乙的简单气态氢化物的稳定性强于![]()
D.推测乙可以用作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容中发生下列反应aA(g)![]() cC(s)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(s)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时D的浓度为原平衡的1.8倍,下列叙述正确的是
( )
A.A的转化率变小B.平衡向正反应方向移动
C.D的体积分数变大D.可能a > d
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com