
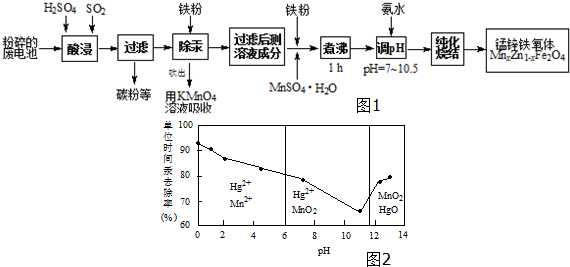
分析 以含锰废旧碱性锌锰电池为原料制备锰锌铁氧体,二氧化硫能与二氧化锰反应生成硫酸锰,过滤除去不溶性杂质碳粉等,滤液中加入铁粉,铁粉具有还原性,能把汞离子还原为汞单质,除去汞,吹出的汞用高锰酸钾溶液吸收,除汞后的溶液加入铁粉、硫酸锰煮沸,纯化烧结得到锰锌铁氧体.
(1)锌锰电池酸浸废电池时,被溶解生成Zn2+的物质有Zn、Zn(OH)2,SO2的作用是还原剂;
(2)①由图可知,pH<6时Hg与酸性高锰酸钾反应生成Hg2+、Mn2+;
②由图可知,随pH值的升高汞的去除率先降低后增加;
(3)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(4)Mn为+2价、Zn为+2价,利用化合价代数和为0,计算Fe元素化合价,再结合Mg、Zn、Fe原子数目之比改写为氧化物形式;结合锰原子守恒可知,补充硫酸锰晶体锰的物质的量等于锰锌铁氧体晶体中锰的物质的量与原废旧碱性锌锰电池中锰元素的物质的量之和,进而计算需补充硫酸锰晶体质量.
解答 解:(1)碱性锌锰干电池工作原理为:Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH,酸浸废电池时,锌被溶解生成Zn2+,Zn(OH)2被溶解生成Zn2+,二氧化硫能与二氧化锰反应生成硫酸锰,SO2的作用是还原剂,
故答案为:Zn、Zn(OH)2;D;
(2)①由图可知,pH<6时Hg与酸性高锰酸钾反应生成Hg2+、Mn2+,反应离子方程式为:5Hg+2MnO4-+16H+=5Hg2++2Mn2++8H2O,
故答案为:5Hg+2MnO4-+16H+=5Hg2++2Mn2++8H2O;
②由图象可知,汞的吸收率随着PH的增大先减小后增大,
故答案为:随pH增大,汞的去除速率先减小后增大;
(3)2MnO(s)+O2(g)═2MnO2(s)△H=-272.0kJ/mol①
MnCO3(s)═MnO(s)+CO2(g)△H=+116.6kJ/mol②
将①+②×2可得:2MnCO3(S)+O2(g)═2MnO2(S)+2CO2(g)△H=[-272.0+2×(+116.6)]kJ/mol=-38.8 kJ/mol;
故答案为:2MnCO3(s)+O2(g)═2MnO2(s)+2CO2(g)△H=-38.8 kJ/mol;
(4)Mn为+2价、Zn为+2价,当x=0.2时,利用化合价代数和为0,可知Fe元素化合价为+3,改写为氧化物形式为:MnO•4ZnO•5Fe2O3,若制得这种锰锌铁氧体的质量为100kg,则锰的物质的量为$\frac{100×0.2}{239}$mol,a kg废旧碱性锌锰电池为原料(含锰元素的物质:MnO2占b%,MnOOH占c%),所含的锰的物质的量为$\frac{a×b%}{87}+\frac{a×c%}{88}$ mol,所以需补充硫酸锰晶体质量169×( $\frac{20}{239}-\frac{ab%}{87}-\frac{ac%}{88}$),
故答案为:MnO•4ZnO•5Fe2O3;169×( $\frac{20}{239}-\frac{ab%}{87}-\frac{ac%}{88}$),
点评 本题考查锰锌铁氧体制备工艺,侧重考查物质的分离提纯、对操作的分析评价、读图获取信息能力等,侧重考查学生对知识的迁移运用,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色,透明,稳定的液体都是溶液 | |
| B. | 悬浊液和乳浊液不稳定,可以放置一段时间后分别用过滤和分液的方法分离. | |
| C. | 胶体区别于其它分散系的本质特征是丁达尔现象 | |
| D. | 电泳现象是胶体特有的一种性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯原子、氯离子、氯气均为黄绿色,且氯离子比氯原子结构稳定 | |
| B. | 氯原子易得电子,所以Cl2在化学反应中氯元素化合价只会降低 | |
| C. | 氯原子、氯离子、氯气分子中原子的最外层均达到8电子结构 | |
| D. | 氯元素在自然界中不存在游离态,只以化合态形式存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
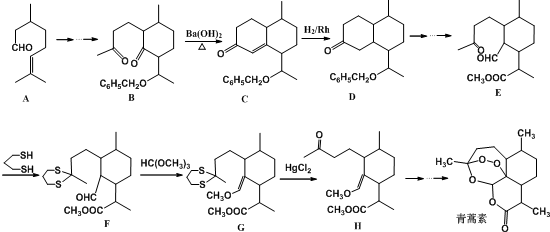
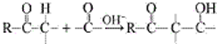
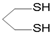 用系统命名法命名,它的名称是1,3-丙二硫醇;
用系统命名法命名,它的名称是1,3-丙二硫醇;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com