
 CO2是自然界中碳循环的主要载体,维持大气中CO2的平衡对生态环境有重要意义.
CO2是自然界中碳循环的主要载体,维持大气中CO2的平衡对生态环境有重要意义.分析 (1)二氧化碳参与光合作用,可以实现CO2在自然界碳循环;
(2)①化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
②已知:Ⅰ.CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ/mol
Ⅱ.2CO(g)+4H2(g)?C2H4(g)+2H2O(g)△H=-210.5kJ/mol
根据盖斯定律,Ⅰ×2+Ⅱ可得:2CO2+6H2(g)=C2H4(g)+4H2O(g);
③要提高CO2的转化率,改变条件应使平衡正向移动,但不能只增大二氧化碳的用量,否则转化率为降低,结合平衡移动原理分析解答;
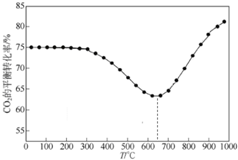
④大于650℃时,第一步反应(吸热)为主,因此升温使CO2转化率增大.
解答 解:(1)二氧化碳参与光合作用,可以实现CO2在自然界碳循环,
故答案为:光合作用;
(2)①CO2(g)+H2(g)?CO(g)+H2O(g)的化学平衡常数表达式K=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$,
故答案为:$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$;
②已知:Ⅰ.CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ/mol
Ⅱ.2CO(g)+4H2(g)?C2H4(g)+2H2O(g)△H=-210.5kJ/mol
根据盖斯定律,Ⅰ×2+Ⅱ可得:2CO2+6H2(g)=C2H4(g)+4H2O(g)△H=-127.9 kJ/mol,
故答案为:2CO2+6H2(g)=C2H4(g)+4H2O(g)△H=-127.9 kJ/mol;
③a.正反应为气体体积减小的反应,低压有利于逆向减小,CO2的转化率减小,故a错误;
b.增大H2浓度,平衡正向移动,CO2的转化率增大,故b正确;
c.加入适当催化剂,可以加快反应速率,但不影响平衡移动,CO2的转化率不变,故c错误;
d.分离出水,生成物浓度减小,平衡正向移动,CO2的转化率增大,故d正确,
故选:bd;
④大于650℃时,第一步反应(吸热)为主,正反应为吸热反应,升高温度平衡正向移动,因此升温使CO2转化率增大,
故答案为:大于650℃时,第一步反应(吸热)为主,因此升温使CO2转化率增大.
点评 本题考查化学平衡影响因素、平衡常数、盖斯定律应用等,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后溶液可能呈中性 | |
| B. | 反应停止后一定有固体剩余 | |
| C. | 反应过程中一定有氧化还原反应发生 | |
| D. | 若只有Cu剩余,向溶液中滴入铁氰化钾溶液不会产生蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO+H2O═Ca(OH)2 | B. | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑ | ||
| C. | 2NaOH+CO2═Na2CO3+H2O | D. | Fe+2HCl═H2↑+FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽车尾气是导致酸雨的原因之一 | B. | 酸雨会使土壤、湖泊酸化 | ||
| C. | 酸雨形成中不涉及氧化还原反应 | D. | 燃煤中加入石灰石可防治酸雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 实验操作 | 实验现象 |
| 实验1 | 向2mL 0.001mol/L NaHCO3溶液中加入1mL 0.1mol/LCaCl2溶液 | 无明显变化.用激光笔照射,没有出现光亮的通路. |
| 实验2 | 向2mL 0.1mol/L NaHCO3溶液中加入1mL 0.1mol/LCaCl2溶液 | 略显白色均匀的浑浊,用激光笔照射,出现光亮的通路. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com