
【题目】某化学小组在查阅文献及实验探究的基础上,深刻地认识了卤素的性质。
I.F2与C12的相似性。1971年N.H.Studier和E.H.Appelman从冰(-40℃)的氟化作用中首次发现F2、C12与水的反应相似。
(1)写出氟气与水发生上述反应的化学方程式_____________________________________。
II.次氯酸钠和氯酸钾的制备。按图装配仪器并检查装置的气密性。

第一步:在锥形瓶内放约3g MnO2粉末,安全漏斗深入试管底部;
第二步:在管6中放4mL 6mol·L-1KOH溶液(放热水浴中),管7中放4mL 2mol· L-1NaOH溶液(放冰水浴中)。打开控制夹3,关闭控制夹4;
第三步:由漏斗加入15mL 9mol·L-1HC1溶液,缓慢加热,控制氯气均匀产生。热水浴温度控制在323K~328K;
第四步:一段时间后,停止加热,……
(2)锥形瓶中用小试管的优点为_________________________________________________。
(3)停止加热后的操作是____________________________________,再将管6和管7拆下。
(4)查阅文献资料知道,将NaC1O溶液加热,NaC1O分解可生成NaC1O3,据此推断若将KC1O3加热至673K,其分解的化学方程式为_____________________________________。
Ⅲ.C1-、Br-、I-的混合液中C1-的鉴定
已知:Ksp(AgC1)=1.8×10-10 Ksp(AgBr)=5.4×10-13 Ksp(AgI)=8.5×10-17
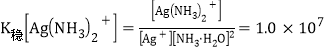
第一步:取2-3滴C1-、Br-、I-的混合液,加1滴6mol·L-1HNO3溶液酸化,滴加0.1mol·L-1AgNO3溶液至沉淀完全,加热2min,离心分离,弃去溶液:
第二步:在沉淀中加入5~10滴2mol·L-1NH3·H2O溶液,剧烈搅拌,并温热1min,离心沉降,移清液于另一只试管中。
(5)已知![]() ,设平衡时[Ag(NH3)2]+浓度为0.1mol·L-1,则溶解AgBr沉淀所需氨水的最低浓度约为_______mol·L-1(
,设平衡时[Ag(NH3)2]+浓度为0.1mol·L-1,则溶解AgBr沉淀所需氨水的最低浓度约为_______mol·L-1(![]() )。
)。
(6)根据上述计算,可推知清液中溶质主要成分的化学式为_________________________。
第三步:清液用6mol·L-1HNO3酸化,
(7)现象是_______________________________________________,证实C1-存在。反应的离子方程式为__________________________________________________。
【答案】F2+H2O![]() HFO+HF 节省药品(答“液封”也对) 关闭控制夹3,打开控制夹4 4KClO3
HFO+HF 节省药品(答“液封”也对) 关闭控制夹3,打开控制夹4 4KClO3![]() 3KClO4+KCl 43(或43.2) [Ag(NH3)2] Cl 有白色沉淀生成 [Ag(NH3)2]++Cl-+2H+=AgCl+2NH4+
3KClO4+KCl 43(或43.2) [Ag(NH3)2] Cl 有白色沉淀生成 [Ag(NH3)2]++Cl-+2H+=AgCl+2NH4+
【解析】
根据氯气和水的反应分析氟和水的反应方程式。根据已知信息,温度高时盐会发生歧化反应分析氯酸钾加热条件下生成的产物。根据溶度积的大小分析沉淀和先后顺序和溶解顺。
(1)根据氯气和水反应生成盐酸和次氯酸分析,氟和水的方程式为:F2+H2O![]() HFO+HF;
HFO+HF;
(2)锥形瓶中放置的为二氧化锰,通过长颈漏斗加入浓盐酸,放置一个小试管时,盐酸将小试管充满后才流出,与二氧化锰接触,并且封住长颈漏斗的下端,即液封,不会让氯气从中逸出,这样做节省药品。
(3)停止加入后,装置中仍产生氯气,关闭控制夹3,打开控制夹4,将剩余的氯气通入5中进行吸收,防止污染。
(4)查阅资料得到,溶液在加热过程中发生歧化反应,同理可知,氯酸钾在温度更高的条件下也能分解,生成高氯酸钾和氯化钾,方程式为:4KClO3![]() 3KClO4+KCl;
3KClO4+KCl;
(5)平衡时[Ag(NH3)2]+浓度为0.1mol·L-1,则溴离子浓度也为0.1 mol·L-1,根据c(Ag+)c(Br-)= 5.4×10-13,  ,分析有
,分析有![]() ,解得NH3·H2O的浓度为43(或43.2)mol/L。
,解得NH3·H2O的浓度为43(或43.2)mol/L。
(6)根据上述计算可知,实验中用于溶解沉淀的氨水的浓度为2mol/L,该浓度远远小于43mol/L,故溴化银不可能溶解。根据溶度积分析,碘化银的溶度积比溴化银更小,故其更不可能溶解,氯化银的溶解度最大,所以在沉淀中加入氨水,只有氯化银溶解,故清液中溶质主要为[Ag(NH3)2] Cl;(7)当清液中加入硝酸时,溶液中有白色沉淀生成,证实有C1-存在,反应的离子方程式为:[Ag(NH3)2]++Cl-+2H+=AgCl+2NH4+.


科目:高中化学 来源: 题型:
【题目】苯分子中不存在碳碳单键、碳碳双键的交替结构,下列可以作为证据的事实是( )
①苯不能使酸性KMnO4溶液褪色
②苯不能因发生化学反应而使溴的四氯化碳溶液褪色
③苯在加热和有催化剂存在的条件下能与H2加成生成环己烷
④苯分子中碳碳键的键长完全相等
⑤邻二氯苯(![]() )只有一种
)只有一种
⑥间二氯苯(![]() )只有一种
)只有一种
A.①②B.①⑤C.③④⑤⑥D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是燃料(如氢气、甲烷、一氧化碳等)跟氧气(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱溶液。下面关于甲烷燃料电池的说法正确的是( )
A. 负极反应式:O2+2H2O+4e-![]() 4OH-
4OH-
B. 负极反应式:CH4+8OH--8e-![]() CO2+6H2O
CO2+6H2O
C. 随着放电的进行,溶液中氢氧根离子的浓度不变
D. 放电时溶液中的阴离子向负极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,向50.00mL未知浓度的氨水中逐滴加入0.5mol·L-1的HC1溶液。滴定过程中,溶液的pOH[pOH=-lgc(OH-)]与滴入HCl溶液体积的关系如图所示,则下列说法中正确的是

A. 图中②点所示溶液的导电能力弱于①点
B. ③点处水电离出的c(H+)=1×10-8mol·L-1
C. 图中点①所示溶液中,c(C1-)>c(NH4+)>c(OH-)>c(H+)
D. 25℃时氨水的Kb约为5×10-5.6mo1·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取氯化铁粉末,已知氯化铁粉末很容易吸水生成结晶化合物FeCl3+6H2O===FeCl3·6H2O。
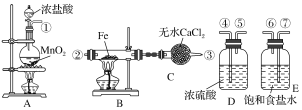
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序):
①接_______________________________________________________
(2)烧瓶A发生的反应中,氧化剂是________(填物质名称),B中反应的化学方程式是___________________。
(3)容器D的作用是_____________________________________________,容器E的作用是__________________________________________________。
(4)A、B中的酒精灯应先点燃________处(填“A”或“B”)的酒精灯,理由是___________________。
(5)这套实验装置是否完整?________(填“是”或“否”),若不完整,还须补充________装置(若第一问填“是”,则此问不需要作答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中烧杯中盛的是天然水,铁腐蚀的速率由快到慢的顺序是( )
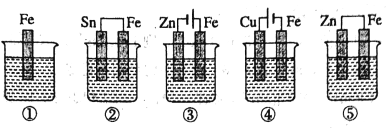
A. ③>②>①>⑤>④ B. ⑤>②>①>③>④ C. ⑤>②>③>④>① D. ③>④>⑤>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,互为同分异构体的是 ( )
A.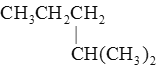 与
与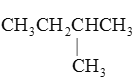
B. 与CH3CH2CH2CH2Cl
与CH3CH2CH2CH2Cl
C.CH4与CH3CH3
D.CH3CH(CH3)CH2CH2CH3与CH3CH2CH2CH(CH3)CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种气体X、Y、Z的相对分子质量关系为Mr(X) < Mr(Y)= 0.5Mr(Z),下列说法正确的是()
A.原子数目相等的三种气体,质量最大的是Z
B.相同条件下,同质量的三种气体,气体密度最小的是X
C.若一定条件下,三种气体体积均为2.24 L,则它们的物质的量一定均为0.1 mol
D.同温下,体积相同的两容器分别充2gY气体和1gZ气体,则其压强比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所给信息,得出的结论正确的是

A.48g碳完全燃烧放出热量为1574 kJ/mol
B.2C(s)+O2(g)![]() 2CO(g) △H=-221.0kJ/mol
2CO(g) △H=-221.0kJ/mol
C.2CO2(g)![]() 2CO(g)+O2(g) △H=+283.0kJ/mol
2CO(g)+O2(g) △H=+283.0kJ/mol
D.C(s)+O2(g)![]() CO2(s) △H=-393.5kJ/mol
CO2(s) △H=-393.5kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com