
 FeCl3在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题:
FeCl3在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题:
| ||
| ||


科目:高中化学 来源: 题型:
| A、硫离子的电子排布式:1s22s22p63s23p4 |
B、H2O的电子式: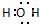 |
C、N原子最外层电子的轨道表示式: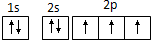 |
D、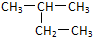 的名称:2-乙基丙烷 的名称:2-乙基丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制溶液时,将量筒中液体倒入烧杯后,应将量筒洗涤,将洗涤液也倒入烧杯 |
| B、用干燥的pH试纸分别测1mol?L-1的NaOH溶液和1mol?L-1的H2SO4的pH |
| C、稀释浓硫酸时,把浓硫酸慢慢倒入盛有水的烧杯中并不断搅拌 |
| D、向酒精灯加酒精时,应将试剂瓶中的酒精直接倒入酒精灯中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
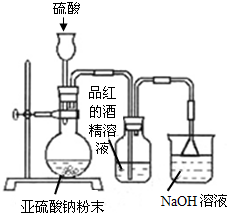 某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.
某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.查看答案和解析>>
科目:高中化学 来源: 题型:
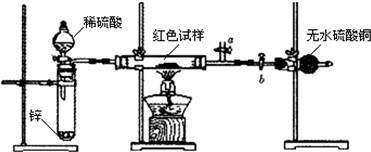 已知:①Cu2O与Cu均为红色固体,Cu2O酸性条件下易发生歧化反应.
已知:①Cu2O与Cu均为红色固体,Cu2O酸性条件下易发生歧化反应.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定温度下,某溶液的pH<7,则该溶液呈酸性 |
| B、在水中加入少量碳酸钠固体将抑制水的电离 |
| C、0.02mol?L-1CH3COOH溶液和0.01mol?L-1NaOH溶液等体积混合,则溶液中:2c(H+)+c(CH3COOH)=2 c(OH-)+c(CH3COO-) |
| D、浓度均为0.1mol/L的NH4Cl溶液和NH4HSO4溶液,前者的c(NH4+)大于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:
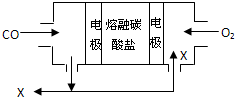 用熔融碳酸盐作电解质,CO、O2为原料组成的新型燃料电池如图所示,为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分X物质参与循环.下列说法错误的是( )
用熔融碳酸盐作电解质,CO、O2为原料组成的新型燃料电池如图所示,为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分X物质参与循环.下列说法错误的是( )| A、X物质的化学式为CO2 |
| B、通入O2的电极为正极 |
| C、负极的电极反应式为CO+CO32--2e-=2CO2 |
| D、电池工作时,转移0.5mol电子,理论上消耗O22.8L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙酸所有原子处于同一平面,含有羧基,可与NaHCO3溶液反应生成CO2 |
| B、苯、乙醇和乙酸都能发生取代反应,乙酸乙酯和食用植物油均可水解生成乙醇 |
| C、乙烯、苯和聚乙烯都能使溴水褪色,褪色的原因相同 |
| D、在烃类有机物分子中,含有的氢原子个数一定是偶数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com