
 某稀硫酸和硝酸的混合溶液200mL,分成两份.向其中一份逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO).向另一份逐渐加入铁粉,产生气体的量随铁粉质量增加的变化曲线如图所示.
某稀硫酸和硝酸的混合溶液200mL,分成两份.向其中一份逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO).向另一份逐渐加入铁粉,产生气体的量随铁粉质量增加的变化曲线如图所示.| n |
| V |
| 11.2g |
| 56g/mol |
| 22.4g |
| 56g/mol |
| 0.4mol |
| 0.1L |


科目:高中化学 来源: 题型:
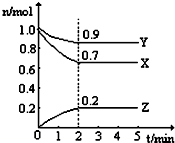 某温度时,在2L固定体积的密闭容器中X、Y、Z三种气体随时间的变化如图所示:
某温度时,在2L固定体积的密闭容器中X、Y、Z三种气体随时间的变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.
水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.| 分子 | H2O | H2S |
| 中心原子杂化方式 | sp3 | |
| 键角 | 104.5° | 92.1° |
| 键长 | 95.7pm | 133.6pm |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+ 立即被还原成Fe2+.据此某学习小组设计如图所示的原电池装置.下列有关说法正确的是( )
298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+ 立即被还原成Fe2+.据此某学习小组设计如图所示的原电池装置.下列有关说法正确的是( )| A、正极反应为Zn-2e-═Zn2+ |
| B、左烧杯中溶液的红色变浅 |
| C、Pt电极上有气泡出现 |
| D、该电池总反应为3Zn+2Fe3+═2Fe+3Zn2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com