
铁元素是典型的变价金属元素,它在化合物中主要表现为+2价和+3价,请归纳总结:
(1)Fe单质通常与哪些氧化剂反应生成 +2价?写出有关反应的化学方程式或离子方程式。
+2价?写出有关反应的化学方程式或离子方程式。
答案 Fe→Fe2+:铁与氧化性比较弱的非金属单质(如S、I2),非氧化性酸(如盐酸、稀硫酸),不活泼金属的盐溶液(如CuSO4溶液)反应,都可实现这种转化。如:Fe+S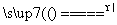 FeS,2H++Fe===Fe2++H2↑,Cu2++Fe===Fe2++Cu。
FeS,2H++Fe===Fe2++H2↑,Cu2++Fe===Fe2++Cu。
(2)Fe单质通常与哪些氧化剂反应生成+3价?写出有关反应的化学方程式。
答案 Fe→Fe3+:铁与强氧化剂(如Cl2、HNO3、浓硫酸)在一定条件下反应都会实现这种转化。例如:2Fe+3Cl2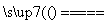 2FeCl3,Fe+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O,2Fe+6H2SO4(浓)
2FeCl3,Fe+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O,2Fe+6H2SO4(浓)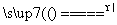 Fe2(SO4)3+3SO2↑+6H2O
Fe2(SO4)3+3SO2↑+6H2O


科目:高中化学 来源: 题型:
下列有机物检验方法正确的是( )
A.取少量卤代烃加NaOH水溶液共热,冷却,再加AgNO3溶液检验卤原子存在
B.用酸性KMnO4溶液直接检验乙醇与浓硫酸反应是否得到乙烯
C.用溴水溶液鉴别苯、苯酚溶液、溴乙烷、乙醇和NaI溶液五种液体
D.用新制CaO检验乙醇中是否含有水分
查看答案和解析>>
科目:高中化学 来源: 题型:
经测定,某有机物含碳77.8%、氢7.4%、氧14.8%;又测得此有机物的蒸气对相同条件下同体积的氢气质量比为54:1,求此有机物的分子式。若此有机物能与烧碱反应,且苯环上的一溴代物只有二种,试写出它的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中的一定量混合气体发生反应: xA(g)+yB(g) zC(g),平衡时测得A的浓度0.50mol/L,保持温度不变,将容器的容积大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol/L。下列有关判断错误的是()
zC(g),平衡时测得A的浓度0.50mol/L,保持温度不变,将容器的容积大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol/L。下列有关判断错误的是()
A.x+y<z B.平衡向逆反应方向移动 C.B的转化率降低 D.C的体积分数下降
查看答案和解析>>
科目:高中化学 来源: 题型:
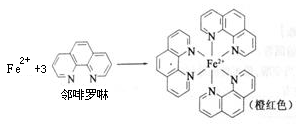
元素周期表中第四周期的金属元素在生产和科研中有非常重要的使用价值。
(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰。相关的反应如下:4FeCl3+2NH2OH·HCl=4FeCl2+N2O+6HCl+H2O
①Fe3+在基态时,核外电子排布式 。
 ②羟胺(NH2OH)中O采用 杂化。
②羟胺(NH2OH)中O采用 杂化。
③Fe2+与邻啡罗啉形成的配合物中,配体数为 。
(2)向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的晶体[Cu(NH3)4]SO4·H2O,该晶体中含有的化学键类型是 。
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+,已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是 。
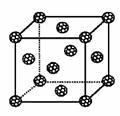
(4)现把C60抽象成质点,该晶体的晶胞结构如右图所示,如果把晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,第四周期电负性最小的原子可作为容体掺入C60晶体的空隙中,形成具有良好的超导性的掺杂C60化合物。若每个四面体空隙填入一个原子,则全部填满C60晶体的四面体空隙后,所形成的掺杂C60化合物的化学式为 。若C60的半径为apm,则掺杂C60化合物密度为 g/cm3。(阿伏加德罗常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150 mL 4 mol·L-1的稀硝酸恰好使混合物完全溶解,放出2.24 L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
( )
A.0.21 mol B.0.25 mol
C.0.3 mol D.0.35 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
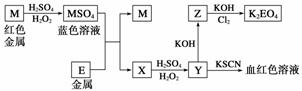
(1)写出M溶于稀硫酸和H2O2混合液的化学方程式________________________。
(2)某同学取X的溶液,酸化后加入KI淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式________________________、________________________。
(3)写出Cl2将Z氧化为K2EO4的化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
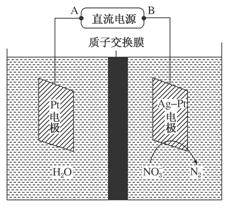
电化学降解法治理水中硝酸盐的污染原理如图所示。下列说法正确的是
A.B为电源正极
B.电解过程中H+ 向阳极移动
C.阴极反应式为2NO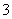 +6H2O+10e-= N2↑+12OH-
+6H2O+10e-= N2↑+12OH-
D.理论上电解过程中阴、阳两极产生的气体在同温同压下体积比为2︰5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com