
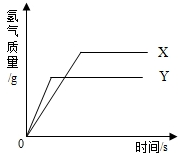
 现有等质量的X、Y两种金属,分别放入溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如右图所示(已知X、Y在生成物中化合价均为+2价).则下列说法中不正确的是( )
现有等质量的X、Y两种金属,分别放入溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如右图所示(已知X、Y在生成物中化合价均为+2价).则下列说法中不正确的是( )| A. | 生成氢气的质量:X>Y | B. | 相对原子质量:X>Y | ||
| C. | 金属活动性:Y>X | D. | 消耗硫酸的质量:X>Y |
分析 A、根据图象分析生成氢气的质量;
B、根据X、Y在生成物中化合价均为+2价,可知等质量的金属与足量的稀硫酸完全反应,产生氢气的质量与金属的相对原子质量成反比分析;
C、据相同时间内产生氢气较多(即反应剧烈)的金属活动性较强,结合产生氢气的关系图判断两种金属活动性;
D、根据质量守恒定律定律可知,生成氢气的质量取决于消耗的硫酸的质量.
解答 解:A、根据反应生成H2的质量与反应时间的关系图所示,在两种金属完全反应后,放出H2的质量是X>Y,故A正确;
B、X、Y金属的化合价、金属的质量都相等,完全反应放出氢气的质量与金属的相对原子质量成反比,即产生氢气多的相对原子质量小;根据反应生成H2的质量与反应时间的关系图所示,在金属完全反应后,放出H2的质量是X>Y,因此可判断相对原子质量是Y>X,故B错误;
C、根据反应生成H2的质量与反应时间的关系图所示,相同时间内Y放出氢气的质量大于X,可判断金属活动性顺序是Y>X,故C正确;
D、金属与酸的反应生成氢气时,氢气来源于酸中的氢元素,所以生成的氢气与消耗的酸的多少顺序一致,消耗硫酸的质量:X>Y,故D正确;
故选:B.
点评 活动性越强的金属与酸反应越剧烈,即反应放出氢气的速度越快;化合价相同的等质量金属完全反应放出氢气的质量与金属的相对原子质量成反比,据此结合图象细心分析解答.


科目:高中化学 来源: 题型:实验题
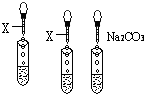 实验室有三瓶失去标签的无色溶液:氯化钾、氢氧化钙和稀硫酸,可用一种常见酸碱指示剂X 或Na2CO3一次鉴别它们.根据有关操作及所加试剂填空.
实验室有三瓶失去标签的无色溶液:氯化钾、氢氧化钙和稀硫酸,可用一种常见酸碱指示剂X 或Na2CO3一次鉴别它们.根据有关操作及所加试剂填空.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
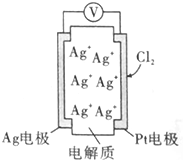 原电池的应用极为广泛.利用如下图所示原电池可测量空气中Cl2的含量,其中电解质是Ag+可以自由移动的固体物质,下列分析正确的是( )
原电池的应用极为广泛.利用如下图所示原电池可测量空气中Cl2的含量,其中电解质是Ag+可以自由移动的固体物质,下列分析正确的是( )| A. | 电流经外电路从Ag流向Pt电极 | |
| B. | 电池工作时,电解质中Ag+数目增多 | |
| C. | 正极反应:Cl2+2e-=2Cl- | |
| D. | 空气中c(Cl2)越大,Ag极消耗速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 4.4 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 | B. | 0.2 | C. | 0.3 | D. | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 重铬酸钾(K2Cr2O7)是一种重要的氧化剂,可以检验司机是否酒后驾驶.Cr2O72-+3C2H5OH+16H+=41Cr(H2O)6]3++3CH3COOH
重铬酸钾(K2Cr2O7)是一种重要的氧化剂,可以检验司机是否酒后驾驶.Cr2O72-+3C2H5OH+16H+=41Cr(H2O)6]3++3CH3COOH查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com