
| 化学健 | C≡O | H-H | C-H | H-O |
| 键能(kJ/mol) | a | b | c | d |
| 1.4mol |
| 2L |
| 0.9mol/L |
| 3min |
| c(CH3OH) |
| c(CO)c2(H2) |
| c(CH3OH) |
| c(CO)c2(H2) |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、脱氧过程是吸热反应,可降低温度,延长糕点保质期 |
| B、含2.24g铁粉的脱氧剂,理论上最多能吸收氧气672mL(标准状况) |
| C、脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4 e-=4OH- |
| D、脱氧过程中铁作原电池正极,电极反应为:Fe-2e-=Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
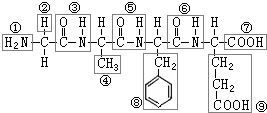
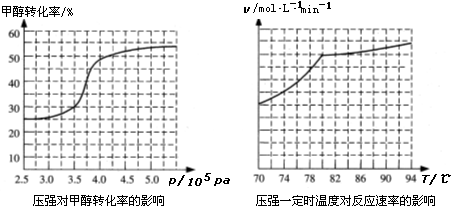
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
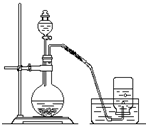 利用如图所示装置制取氧气并进行相关的实验探究.
利用如图所示装置制取氧气并进行相关的实验探究.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
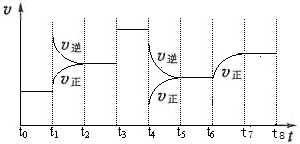
查看答案和解析>>
科目:高中化学 来源: 题型:
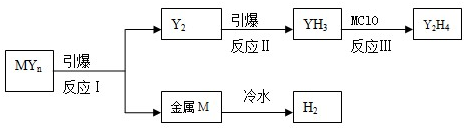
n(YH3)(mol) 温度 | 3min | 4min | 5min | 6min |
| T1 | 0.8 | 1.0 | 1.2 | 1.2 |
| T2 | 0.7 | 0.8 | 1.0 | 1.0 |
| 1 |
| 2 |
| c(H2) |
| c(YH3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com