
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏、煤的气化属物理变化;石油的裂解、煤的干馏属化学变化 | |
| B. | 铝及合金是日常生活广泛使用的材料,通常用电解氯化铝的方法制取铝 | |
| C. | 绿色化学期望从源头消除污染,生产过程中充分利用原料,实现零排放 | |
| D. | 在江河入海口的钢铁闸门上安装铜块或锌块,均可防止钢铁闸门被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液中加入过量稀氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ | |
| B. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO${\;}_{2}^{-}$+2H2O═Al(OH)3↓+HCO${\;}_{3}^{-}$ | |
| C. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO${\;}_{2}^{-}$+3H2↑ | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO${\;}_{4}^{2-}$恰好完全沉淀:2Ba2++3OH-+Al3++2SO${\;}_{4}^{2-}$═2BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 28g乙烯(C2H4)和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| C. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 0.5molO3与11.2LO2所含的分子数一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
| ③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
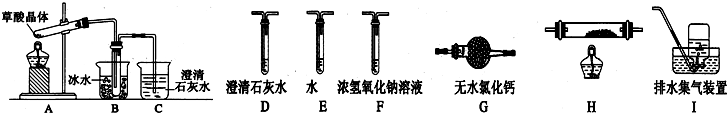
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v正(CO)=v逆(H2O) | |
| B. | 2 mol H-O键断裂的同时有1 mol H-H键形成 | |
| C. | 生成n mol CO的同时生成n mol H2O(g) | |
| D. | 体系的压强不再发生变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com