
【题目】由反应物X 转化为 Y 或 Z 的能量变化如图所示。下列说法正确的是
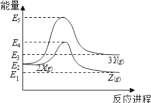
A.由X→Z反应的ΔH=E2-E1
B.反应2X(g) = 3Y(g)的活化能=E3-E2
C.2X(g) = Z(s) ΔH<E1-E2
D.由图可知,X(g)、Y(g)、Z(g)的稳定性情况为:Z(g)>X(g)>Y(g)
科目:高中化学 来源: 题型:
【题目】氢卤酸的能量关系如图所示下列说法正确的是
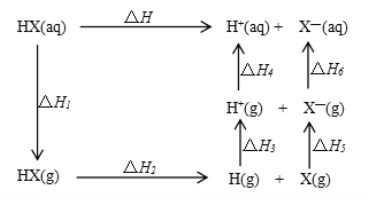
A. 已知HF气体溶于水放热,则HF的△H1<0
B. 相同条件下,HCl的△H2比HBr的小
C. 相同条件下,HCl的△H3+△H4比HI的大
D. 一定条件下,气态原子生成1molH-X键放出akJ能量,则该条件下△H2=+akJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1999年4月,比利时查出污染鸡的根源是生产鸡饲料的油脂被二恶英所污染,二恶英是两大芳香族化合物的总称。其中四氯代二苯并二恶英毒性最大,其结构简式为:
下列有关该化合物的说法中正确的是( )

A. 分子式为C12H8O2Cl4
B. 是一种可溶于水的气体
C. 是最危险的致癌物之一
D. 是一种多卤代烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应路线及所给信息填空:
A![]()
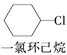
![]()
![]()
![]() B
B![]()
![]() (1,3—环己二烯)
(1,3—环己二烯)
(1)A的结构简式是____,名称是______。
(2)①的反应类型是_______,③的反应类型是______。
(3)反应④的化学方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2 是大气污染的主要污染物之一,硝酸盐是水体污染的污染物之一,电化学降解酸性 NO3-的原理如图所示,下列说法正确的是

A.电源正极为 b
B.阴极电极反应式为 2NO3-+ 6H2O +10e-= N2↑+12 OH-
C.两电极上产生的气体物质的量之比 n(O2):n(N2) = 5:2
D.将阳极换成铜电极,反应不发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将 Cl2通入适量 NaOH 溶液,产物中可能有 NaCl、NaClO、NaClO3,且 的值仅与温度高低有关。当n(NaOH)=6a mol 时,下列有关说法不正确的是
的值仅与温度高低有关。当n(NaOH)=6a mol 时,下列有关说法不正确的是
A.参加反应的氯气的物质的量 3amol
B.改变温度,产物中NaCl 的最小理论产量为 3a mol
C.改变温度,反应中转移电子的物质的量 n 的范围:3a mol≤n≤5a mol
D.某温度下,反应后 ,则溶液中
,则溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是汽车安全气囊最理想的气体发生剂原料。下面是工业水合肼法制备叠氮
化钠的工艺流程:

已知 NaN3 能与 AgNO3 反应生成白色难溶于水的 AgN3;Ag2CrO4 呈红色,可溶于水。有关物质的物理性质如下表:
熔点℃ | 沸点℃ | 溶解性 | |
CH3OH | -9 | 64.7 | 与水互溶 |
水合肼(N2H4H2O) | 2 | 113.5 | 与水、醇互溶,不溶于乙醚和氯仿 |
亚硝酸甲酯(CH3ONO) | -17 | -12 | 难溶于水,可溶于乙醇、乙醚 |
NaN3 | 275 | 300 | 易溶于水,难溶于乙醇 |
请回答:
(1)步骤Ⅰ中NaNO2 与稀硫酸发生副反应生成两种气体(其中一种气体在空气中可以转化为另一种气体)的离子方程式为_____;步骤Ⅱ中生成 NaN3 的化学方程式为_____
(2)实验室模拟步骤Ⅱ实验装置如图(装置中冷却水省略,下同):根据实验发现温度在 20℃左右反应的选择性和转化率最高,但是该反应属于放热反应,因此需要采取的措施是_____。
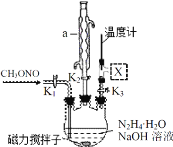
(3)步骤Ⅱ、Ⅲ中制备叠氮化钠并对溶液 A 进行蒸馏的合理操作顺序是_____。
①打开 K1、K2,关闭 K3 ②打开 K3 ③加热 ④关闭 K1、K2
(4)步骤Ⅳ对溶液B 加热蒸发至溶液体积的 1/3,NaN3 结晶析出。
①步骤Ⅴ最好选用_____洗涤晶体。
A.水 B.乙醇 C.乙醚
②沉淀滴定法测定产品纯度,是以淡黄色 K2CrO4 溶液作指示剂,将 AgNO3 标准溶液滴入样品溶液, 滴定终点现象为_________。AgNO3 溶液要装在_____滴定管里进行滴定。下列说法正确的是_____。
A.滴定管和移液管管尖不可接触锥形瓶内壁
B.滴定时滴液速度应先快后慢,接近终点时一滴一摇
C.滴定过程中可用蒸馏水将锥形瓶壁上粘附的溶液冲下
D.若发现滴液过量,可回滴样品溶液
E.若未等滴定管液面稳定就读数会导致测定结果偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素[CO(NH2)2]是可由无机化合物合成的有机化合物,通常用作植物的氮肥。
(1)合成尿素的主要反应如下:
i.2NH3(g)+CO2(g)![]()
![]() (l)(氨基甲酸铵)△H=-159.5kJ·mol-1
(l)(氨基甲酸铵)△H=-159.5kJ·mol-1
ii. ![]() (l)
(l)![]()
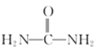 (l)+H2O(g)△H=+116.5kJ·mol-1
(l)+H2O(g)△H=+116.5kJ·mol-1
①CO2和NH3合成尿素的热化学方程式是____。
②工业上提高氨碳比[![]() (原料用量均增大),可以提高尿素的产率,结合反应i~ii,解释尿素产率提高的原因: ____。
(原料用量均增大),可以提高尿素的产率,结合反应i~ii,解释尿素产率提高的原因: ____。
(2)某科研小组模拟工业合成尿素,一定条件下,在0.5 L的密闭容器中充入4 mol NH3和1molCO2,测得反应中各组分的物质的量随时间变化如图所示。.
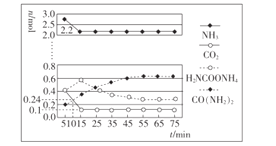
①反应进行到10 min时,用CO2表示反应i的速率v(CO2)=___。
②已知总反应的快慢由慢的一步反应决定,则合成尿素总反应进行到___min时达到平衡。
③合成尿素总反应的平衡常数为____。
(3)我国研制出金属镍钼基高效电催化剂,实现电解富尿素废水低能耗制H2(装置如图)。
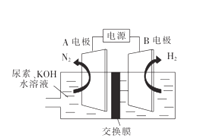
①电极B为___(填“阴”或“阳”)极。
②A电极的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验淀粉水解的产物,设计如下实验方案:
![]()
请回答下列问题:
(1)试剂1为20%的H2SO4溶液,其作用是_________;
(2)试剂2为_________NaOH溶液,其作用是_________,使检验水解产物的实验得以顺利进行;发生反应的离子方程式为:_________;
(3)反应①的化学方程式为_________;
(4)为检验淀粉液是否已完全水解,取少量水解液于试管中,加入碘水,则证明淀粉未完全水解的现象是_________;
(5)如果实验过程中没有加入试剂2而直接加入试剂3,能否实现实验目的_________(填”能”或”否”)否,若不能,其原因是_________硫酸能溶解Cu(OH)2而使实验失败,最简单的改正措施是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com